题目内容
6.下面是甲、乙、丙三位同学制取乙酸乙酯的过程,请你参与并协助他们完成相关实验任务.【实验目的】制取乙酸乙酯
【实验原理】甲、乙、丙三位同学均采取乙醇、乙酸与浓硫酸混合共热的方法制取乙酸乙酯,该反应的化学方程式为CH3COOH+C2H5OH
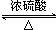 CH3COOC2H5+H2O.
CH3COOC2H5+H2O.【装置设计】甲、乙、丙三位同学分别设计了下列三套实验装置:
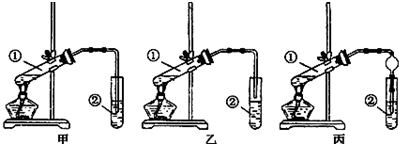
若从甲、乙两位同学设计的装置中选择一套作为实验室制取乙酸乙酯的装置,选择的装置应是乙(填“甲”或“乙”).丙同学将甲装置中的玻璃管改成了球形干燥管,除起冷凝作用外,另一重要作用是防止倒吸.
【实验步骤】
A 按所选择的装置组装仪器,在试管①中先加入3mL95%的乙醇,并在摇动下缓缓加入2mL浓硫酸充分摇匀,冷却后再加入2mL冰醋酸;
B 将试管固定在铁架台上;
C 在试管②中加入5mL X试剂;
D 用酒精灯对试管①加热
E.当观察到试管②中有明显现象时停止实验.
【问题讨论】
(1)实验中浓硫酸的作用是催化、吸水.
(2)试管2中加入的X试剂为饱和碳酸钠溶液.
(3)步骤E试管②中观察到的现象是液体分为两层(有水果味).
(4)常用分液方法分离获得实验中的乙酸乙酯.
分析 【实验原理】乙酸和乙醇在浓硫酸作用下发生酯化反应,生成乙酸乙酯和水;
【装置设计】酸和乙醇易溶于水,不插入液面下是为了防止倒吸,所以选乙装置;球形干燥管导气的同时也起到防倒吸作用;
【问题讨论】(1)浓硫酸有吸水性,促进该反应向正反应方向移动,浓硫酸能加快反应速率,所以浓硫酸作催化剂和吸水剂;
(2)碳酸钠溶液中的水溶解乙醇,能跟乙酸反应吸收乙酸,便于闻到乙酸乙酯的香味,而乙酸乙酯难溶于饱和碳酸钠溶液;
(3)乙酸乙酯难溶于饱和碳酸钠溶液,所以步骤E试管②中液体分层;
(4)因为乙酸乙酯难溶于饱和碳酸钠溶液,分离互不相溶液体的方法是分液.
解答 解:【实验原理】乙酸和乙醇在浓硫酸作用下发生酯化反应,生成乙酸乙酯和水,化学方程式为CH3COOH+C2H5OH CH3COOC2H5+H2O,
CH3COOC2H5+H2O,
故答案为:CH3COOH+C2H5OH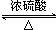 CH3COOC2H5+H2O;
CH3COOC2H5+H2O;
【装置设计】酸和乙醇易溶于水,不插入液面下是为了防止倒吸,所以选乙装置;球形干燥管导气的同时也起到防倒吸作用,
故答案为:乙;防止倒吸;
【问题讨论】(1)浓硫酸有吸水性,促进该反应向正反应方向移动,浓硫酸能加快反应速率,所以浓硫酸作催化剂和吸水剂,所以实验中浓硫酸的作用是:催化、吸水,故答案为:催化、吸水;
(2)碳酸钠溶液中的水溶解乙醇,能跟乙酸反应吸收乙酸,便于闻到乙酸乙酯的香味,而乙酸乙酯难溶于饱和碳酸钠溶液,所以试管2中加入的X试剂为:饱和碳酸钠溶液,故答案为:饱和碳酸钠溶液;
(3)乙酸乙酯难溶于饱和碳酸钠溶液,所以步骤E试管②中观察到的现象是:液体分为两层(有水果味),故答案为:液体分为两层(有水果味);
(4)因为乙酸乙酯难溶于饱和碳酸钠溶液,分离互不相溶液体的方法是分液,所以常用分液分离获得实验中的乙酸乙酯,故答案为:分液.
点评 本题考查制备实验方案的设计,为高频考点,把握乙酸乙酯的制备原理、实验装置的作用、混合物分离提纯方法为解答的关键,侧重分析与实验能力的考查,题目难度不大.

| A. | 新制氯水 | B. | 久置氯水 | C. | 氯化钠 | D. | 氯化氢 |
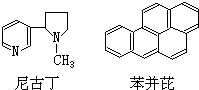 吸烟是人类的一种不良嗜好,也是生活环境中的特殊大气污染源,它对人体健康危害极大,据分析吸烟生成的物质至少有700多种,其中大部分为有毒有害物质.危害最大的物质中有两种是尼古丁和苯并芘,前者的成人致死量约为40~60mg,相当于一包香烟产生的尼古丁的总量;后者是最强的致癌物之一.它们的结构简式分别为:
吸烟是人类的一种不良嗜好,也是生活环境中的特殊大气污染源,它对人体健康危害极大,据分析吸烟生成的物质至少有700多种,其中大部分为有毒有害物质.危害最大的物质中有两种是尼古丁和苯并芘,前者的成人致死量约为40~60mg,相当于一包香烟产生的尼古丁的总量;后者是最强的致癌物之一.它们的结构简式分别为:下列有关尼古丁或苯并芘的叙述正确的是( )
| A. | 尼古丁的分子式为C10H14N2 | |
| B. | 尼古丁分子中的所有原子都在同一平面上 | |
| C. | 苯并芘的分子式为C20H18 | |
| D. | 苯并芘分子中含有苯环结构单元,是苯的同系物 |
| A. | α粒子 | B. | 质子 | C. | 中子 | D. | ${\;}_{1}^{1}$ H |
| A. | 100kg | B. | 160kg | C. | 240kg | D. | 300kg |
| A. | NaOH+HCl═NaCl+H2O | B. | 2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3 | ||
| C. | SO3+H2O═H2SO4 | D. | NH4HCO3 $\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O+CO2↑ |
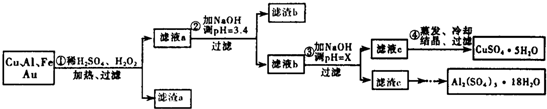
部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Al(OH3) | Cu(OH)2 |
| 开始沉淀 | 1.1 | 4.0 | 5.4 |
| 完全沉淀 | 3.2 | 5.2 | 6.7 |
(2)Cu可溶于稀硫酸与H2O2的混合溶液,其离子方程式是Cu+H2O2+2H+═Cu2++2H2O.
(3)滤渣a的主要成分是Au.
(4)步骤③中X的取值范围是5.2≤X<5.4.
(5)为了测定硫酸铜晶体的纯度,该组甲同学准确称取4.0g样品溶于水配成100mL溶液,取10mL溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI和淀粉指示剂,用0.1000mol•L-1Na2S2O3标准溶液滴定至终点.共消耗14.00mL
Na2S2O3标准溶液.上述过程中反应的离子方程式如下:
2Cu2++4I-═2CuI(白色)↓+I2 2${S_2}O_3^{2-}$+I2═2I-+${S_4}O_6^{2-}$
①样品中硫酸铜晶体的质量分数为87.5%.
②该组乙同学提出通过直接测定样品中$SO_4^{2-}$的量也可求得硫酸铜晶体的纯度,老师审核后予以否决,其原因是样品中含有Na2SO4等杂质.
(6)请你设计一个由滤渣c得到Al2(SO4)3•18H2O的实验方案将滤渣c加入稀硫酸溶解,然后蒸发、浓缩、冷却、结晶、过滤得到Al2(SO4)2•18H2O晶体.
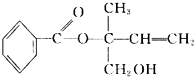
| A. | 有机物M和油脂都含有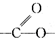 ,两者在酸性或碱性条件下都能发生取代反应 ,两者在酸性或碱性条件下都能发生取代反应 | |
| B. | M在一定条件下能发生加聚反应,不能发生酯化反应 | |
| C. | 在Ni作催化剂的条件下,1 mol M最多只能与1molH2加成 | |
| D. | 不可用酸性高锰酸钾溶液区分苯和M |
