题目内容
18.二氧化氯(ClO2)作为一种高效强氧化剂已被联合国世界卫生组织(WHO)列为AI级安全消毒剂.常温下二氧化氯为黄绿色或橘黄色气体,性质非常不稳定,温度过高或水溶液中ClO2的质量分数高于30%等均有可能引起爆炸,易与碱液反应生成盐和水.(1)某研究小组设计如图所示实验制备ClO2溶液,其反应的化学方程式为
2KClO3+H2C2O4+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2KHSO4+2ClO2+2CO2+2H2O.

①在反应开始之前将烧杯中的水加热到80℃,然后停止加热,并使其温度保持在60~80℃之间.控制温度的目的是使反应正常进行,并防止温度过高引起爆炸.
②装置A用于溶解产生的二氧化氯气体,其中最好盛放b(填字母).
a.20mL 60℃的温水 b.100mL冰水
c.100mL饱和食盐水 d.100mL沸水
③在烧瓶中加入12.25g KClO3和9g草酸(H2C2O4),然后再加入足量的稀硫酸,水浴加热,反应后生成ClO2的质量为6.75g
(2)用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(Cl2-).饮用水中ClO2、Cl2-的含量可用连续碘量法进行测定,实验步骤如下:
步骤1:准确量取一定体积的水样加入锥形瓶中;
步骤2:调节水样的pH至7.0~8.0;
步骤3:加入足量的KI晶体;
步骤4:加入少量指示剂,用一定浓度的Na2S2O3溶液滴定至终点;
步骤5:再调节溶液的pH2.0;
步骤6:继续用相同浓度的Na2S2O3溶液滴定至终点.
步骤1中若要量取20.00mL水样,则应选用的仪器是25mL酸式滴定管.
②步骤1~4的目的是测定水样中ClO2的含量,其反应的化学方程式为:2ClO2+2KI═2KClO2+I2,2Na2S2O3+I2═Na2S4O6+2NaI,则步骤4中加入的指示剂为淀粉溶液,滴定达到终点时溶液的颜色变化为溶液蓝色褪去,且30秒内不恢复蓝色.
③步骤5的目的是用I-将溶液中的Cl2-还原为Cl-以测定其含量,该反应的离子方程式为ClO2-+4I-+4H+=Cl-+2I2+2H2O.
分析 (1)①由题目所给信息可知,温度过高,二氧化氯的水溶液有可能爆炸,应降低反应温度;
②常温下二氧化氯为黄绿色或橘黄色气体,性质非常不稳定,为防止在较高温度下发生爆炸,应用冷水吸收;
③根据氯酸钾和草酸的质量关系判断反应的过量问题,计算生成二氧化氯的质量;
(2)①用ClO2处理过的饮用水(pH为5.5~6.5),水样呈酸性,应选用酸式滴定管量取水样;
②碘与淀粉变蓝,用淀粉溶液作指示剂,反应中生成碘单质显示蓝色,反应后无碘单质,蓝色褪去;
③根据I-被氧化为I2,ClO2-还原为Cl-书写离子方程式.
解答 解:(1)①由题目所给信息可知,温度过高,二氧化氯的水溶液有可能爆炸,应降低反应温度,温度低于100℃的水浴加热,用温度计控制温度,
故答案为:使反应正常进行,并防止温度过高引起爆炸;
②二氧化氯易溶于水,则可用水吸收,为防止温度过高而爆炸,应在低温下吸收,则b符合,故答案为:b;
③n(KClO3)=$\frac{12.25g}{122.5g/mol}$=0.1mol,n(H2C2O4)=$\frac{9g}{90g/mol}$=0.1mol,
根据方程式2KClO3+H2C2O4+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2ClO2↑+2CO2↑+2KHSO4+2H2O可知道,H2C2O4过量,用KClO3的量计算,
则生成的n(ClO2)=0.1mol,m(ClO2)=0.1mol×67.5g/mol=6.75g,
故答案为:6.75g;
(2)①根据题意水样pH为5.5~6.5,呈酸性,且25mL与所量取的体积接近,故用25mL酸式滴定管,
故答案为:25mL酸式滴定管;
②根据题意可知滴定过程中出现了碘单质,碘与淀粉变蓝,故选淀粉做指示剂.滴定到终点时,碘单质正好反应完,故滴定达到终点时溶液的颜色变化为溶液蓝色褪去,且30秒内不恢复蓝色,
故答案为:淀粉溶液;溶液蓝色褪去,且30秒内不恢复蓝色;
③步骤5的目的是用I-将溶液中的ClO2-还原为Cl-以测定其含量,则I-被氧化为I2,故该反应的离子方程式为ClO2-+4I-+4H+=Cl-+2I2+2H2O,
故答案为:ClO2-+4I-+4H+=Cl-+2I2+2H2O.
点评 本题将元素化合物知识与生产工艺结合起来,引导我们关注化学学科的应用性和实践性,我们要在“相关反应化学方程式书写、化学反应条件控制的原理”等方面,加强对元素化合物性质及其转化关系的理解和应用熟悉程度,提高对新信息的处理能力,题目难度中等.

| A. | 6.02×1023个碳原子的质量为1 g | |
| B. | 钠原子的摩尔质量为23 g | |
| C. | HCl的摩尔质量等于6.02×1023个HCl分子的质量 | |
| D. | Na2O2的摩尔质量为78 g/mol |
| A. | 蛋白质、淀粉和油脂都属于高分子化合物 | |
| B. | 人造纤维.合成纤维.碳纤维.光导纤维主要成分都是纤维素 | |
| C. | 误食重金属盐类时,可以喝大量牛奶、蛋清或豆浆解毒 | |
| D. | 福尔马林主要成分是甲酸,由于可使蛋白质变性,可用于保存动物标本 |
| A. | 20 g D2O所含的电子数为10 NA | |
| B. | 25℃时,pH=13的Ba(OH)2溶液中含有的OH-数目为0.1 NA | |
| C. | 1 mo1 Na被氧化成Na2O2,失去电子数目为2 NA | |
| D. | 氢气与氯气反应生成标准状况下22.4 L氯化氢,断裂化学键总数为2 NA |
| A. | KOH | B. | MgCl2 | C. | HCl | D. | N2 |
| A. | pH=12的溶液:NO3-、I-、Na+、Al3+ | |
| B. | 0.1mol•L-1 CH3COONa溶液:Mg2+、H+、Cl-、SO42+ | |
| C. | Kw/c(H+)=0.1mol•L-1 的溶液:Na+、K+、SiO32-、NO3- | |
| D. | 0.1mol•L-1 KMnO4溶液:Na+、Mg2+、NO3-、SO32- |

 CH3COOC2H5+H2O.
CH3COOC2H5+H2O.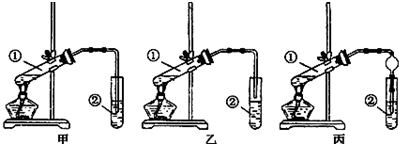
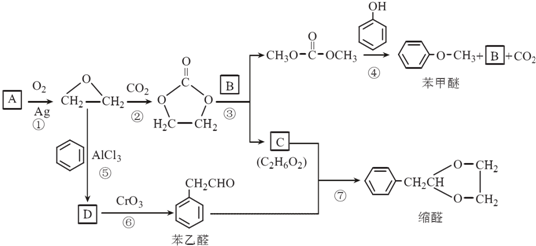
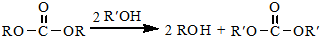
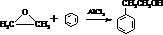 .
.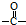 结构,核磁共振氢谱有4组峰,峰面积之比为3:2:2:1.
结构,核磁共振氢谱有4组峰,峰面积之比为3:2:2:1.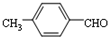 ,
,
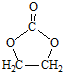 的合成路线,设计一条由2-氯丙烷和必要的无机试剂制备
的合成路线,设计一条由2-氯丙烷和必要的无机试剂制备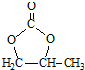 的合成路线(注明必要的反应条件).
的合成路线(注明必要的反应条件).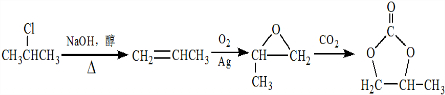 .
.