题目内容
19.已知在100℃下,水的离子积KW=1×10-12,下列说法正确的是( )| A. | 0.05 mol•L-1 的 H2SO4 溶液 pH=1 | |
| B. | 0.001 mol•L-1 的 NaOH 溶液 pH=ll | |
| C. | 0.005 mol•L-1的H2SO4溶液与0.01 mol•L-1的NaOH溶液等体积混合,混合后溶液pH为5,溶液显酸性 | |
| D. | 完全中和pH=3的H2SO4溶液50 mL,需要PH=11的NaOH溶液50mL |
分析 100℃的温度下,水的离子积KW=1×10-12,所以该温度下的中性溶液中pH=6,pH小于6的为酸性溶液,大于6的为碱性溶液,pH=-lgc(H+),强酸和强碱反应的混合溶液呈中性时,氢离子和氢氧根离子的物质的量相等,注意碱性溶液中氢氧根离子浓度的计算方法.
解答 解:100℃的温度下,水的离子积KW=1×10-12,该温度下的中性溶液中pH=6,
A.0.05 mol•L-1的硫酸溶液中,c(H+)=0.05 mol•L-1×2=0.1mol/L,该溶液的pH=1,故A正确;
B.0.001mol/L的氢氧化钠溶液,c(H+)=$\frac{1×1{0}^{-12}}{1×1{0}^{-3}}$mol/L=10-9 mol/L,该溶液的pH=9,故B错误;
C.0.005 mol•L-1的硫酸与0.01 mol•L-1的氢氧化钠溶液等体积时,n(H+)=n(OH-),所以硫酸和氢氧化钠恰好反应,溶液呈中性,反应后溶液的pH为6,故C错误;
D.pH=3的硫酸中,c(H+)=10-3mol/L,pH=11的NaOH溶液中c(OH-)=0.1mol/L,中和pH=3的硫酸溶液50mL,需要pH=11的NaOH溶液0.5mL,故D错误;
故选A.
点评 本题考查pH的简单计算,题目难度不大,明确溶液酸碱性与溶液pH的关系为解答关键,注意掌握pH的概念及表达式,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
9.下列关于电解质电离的叙述中,正确的是( )
| A. | 碳酸钙在水中溶解度很小,其溶液的电阻率很大,所以碳酸钙是弱电解质 | |
| B. | 碳酸钙在水中的溶解度很小,但被溶解的碳酸钙全部电离,所以碳酸钙是强电解质 | |
| C. | 氯气和氨气的水溶液导电性都很好,所以它们是强电解质 | |
| D. | 水难电离,纯水几乎不导电,所以水是非电解质 |
7.下列物质间的反应,其能量变化符合如图所示的是( )
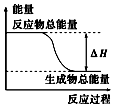

| A. | 铝粉与氧化铁在加热条件下的反应 | |
| B. | 灼热的碳与二氧化碳反应 | |
| C. | Ba(OH)2•8H2O晶体和NH4Cl晶体混合 | |
| D. | 碳与水高温条件下制取水煤气的反应 |
4.下列各组离子一定能大量共存的是( )
| A. | 在含有大量Al3+的无色溶液中:Cu2+、Na+、Cl-、SO42- | |
| B. | 在含有大量H+的溶液中:Na+、K+、CO32-、NO3- | |
| C. | 在强酸的溶液中:NH4+、Na+、SO42-、Cl- | |
| D. | 在滴加石蕊显蓝色的溶液中:K+、Cu2+、Cl-、NO3- |
1.CoCl2•6H2O是一种饲料营养强化剂.一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2•6H2O的工艺流程如下:
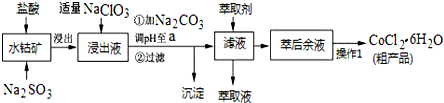
已知:
①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
③CoCl2•6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴.
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“加Na2CO3调pH至a”,过滤所得到的两种沉淀的化学式为Fe(OH)3、Al(OH)3.
(4)萃取剂对金属离子的萃取率与pH的关系如图.向“滤液”中加入萃取剂的目的是除去溶液中的Mn2+;其使用的最佳pH范围是B.
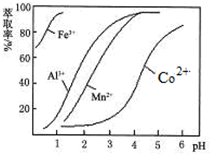
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5.

已知:
①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“加Na2CO3调pH至a”,过滤所得到的两种沉淀的化学式为Fe(OH)3、Al(OH)3.
(4)萃取剂对金属离子的萃取率与pH的关系如图.向“滤液”中加入萃取剂的目的是除去溶液中的Mn2+;其使用的最佳pH范围是B.

A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5.
18.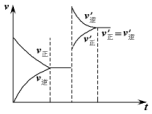 如图表示在密闭容器中反应C(s)+H2O(g)$\stackrel{高温}{?}$CO(g)+H2(g);△H>0,达到平衡后,由于条件的改变而引起正、逆反应速率的变化,以及平衡移动的状况.据图可知,改变的条件是( )
如图表示在密闭容器中反应C(s)+H2O(g)$\stackrel{高温}{?}$CO(g)+H2(g);△H>0,达到平衡后,由于条件的改变而引起正、逆反应速率的变化,以及平衡移动的状况.据图可知,改变的条件是( )
 如图表示在密闭容器中反应C(s)+H2O(g)$\stackrel{高温}{?}$CO(g)+H2(g);△H>0,达到平衡后,由于条件的改变而引起正、逆反应速率的变化,以及平衡移动的状况.据图可知,改变的条件是( )
如图表示在密闭容器中反应C(s)+H2O(g)$\stackrel{高温}{?}$CO(g)+H2(g);△H>0,达到平衡后,由于条件的改变而引起正、逆反应速率的变化,以及平衡移动的状况.据图可知,改变的条件是( )| A. | 增加CO浓度 | B. | 升高温度 | C. | 增加水蒸气 | D. | 增大压强 |
19.食品安全问题备受人们关注,但应该区别违法食品添加剂与正常食品添加剂.做馒头的过程中禁止添加的是( )
| A. | 小苏打 | B. | 增白剂 | C. | 蔗糖 | D. | 食盐 |
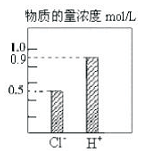 l00mL稀H2S04和稀HC1的混合溶液中,部分离子的浓度关系如图所示,
l00mL稀H2S04和稀HC1的混合溶液中,部分离子的浓度关系如图所示,