题目内容
已知:KSP(AgCl)=1.0×10-19mol2?L-2;
(1)向50mL0.20mol?L-1的AgNO3溶液中加入50mL0.18mol?L-1的盐酸,沉淀生成后溶液中的c(Ag+)= ;
(2)向50mL0.18mol?L-1的AgNO3溶液中加入50mL0.18mol?L-1的盐酸,沉淀生成后溶液中的c(Ag+)= ;
(3)向50mL0.18mol?L-1的AgNO3溶液中加入50mL0.20mol?L-1的盐酸,沉淀生成后溶液中的c(Ag+)= ,pH= .
(1)向50mL0.20mol?L-1的AgNO3溶液中加入50mL0.18mol?L-1的盐酸,沉淀生成后溶液中的c(Ag+)=
(2)向50mL0.18mol?L-1的AgNO3溶液中加入50mL0.18mol?L-1的盐酸,沉淀生成后溶液中的c(Ag+)=
(3)向50mL0.18mol?L-1的AgNO3溶液中加入50mL0.20mol?L-1的盐酸,沉淀生成后溶液中的c(Ag+)=
考点:难溶电解质的溶解平衡及沉淀转化的本质
专题:
分析:(1)依据题干数据计算沉淀后溶液中氯离子浓度,结合Ksp计算溶液中银离子浓度;
(2)依据题干数据计算沉淀后溶液中氯离子浓度,结合Ksp计算溶液中银离子浓度;
(3)依据题干数据计算沉淀后溶液中氯离子浓度,结合Ksp计算溶液中银离子浓度;沉淀后溶液中剩余氢离子浓度,计算pH;
(2)依据题干数据计算沉淀后溶液中氯离子浓度,结合Ksp计算溶液中银离子浓度;
(3)依据题干数据计算沉淀后溶液中氯离子浓度,结合Ksp计算溶液中银离子浓度;沉淀后溶液中剩余氢离子浓度,计算pH;
解答:
解:(1)向50mL0.20mol?L-1的AgNO3溶液中加入50mL0.18mol?L-1的盐酸,混合后两者浓度分别为c(Ag+)=
mol/L=0.1 mol/L、c(Cl-)=
mol/L=0.09mol/L,Ag+与Cl-是等物质的量反应的,此时Ag+过量,过量浓度c(Ag+)=0.1-0.09=0.01mol/L,所以沉淀生成后溶液中的c(Ag+)=0.01mol/L,故答案为:0.01mol/L;
(2)向50mL0.18mol?L-1的AgNO3溶液中加入50mL0.18mol?L-1的盐酸,混合后两者浓度分别为c(Ag+)=
mol/L=0.09 mol/L、c(Cl-)=
mol/L=0.09mol/L,Ag+与Cl-是等物质的量反应的,此时刚好完全反应为饱和溶液,所以溶液中的c(Ag+)=
=1.0×10-9.5mol/L,故答案为:1.0×10-9.5mol/L;
(3)向50ml0.18mol/L的AgNO3溶液中加入50ml0.2mol/L的盐酸,混合后两者浓度分别为c(Ag+)=
mol/L=0.09 mol/L、c(Cl-)=
mol/L=0.1mol/L,Ag+与Cl-是等物质的量反应的,此时Cl-过量,过量浓度c(Cl-)=0.1-0.09=0.01mol/L,
Ksp=c(Ag+)×C(Cl-)=1.0×10-19,则:c(Ag+)=
=1.0×10-17mol/L,
沉淀生成后,氢离子浓度c=
=0.1mol/L,所以pH=1,故答案为:1.0×10-17mol/L;1;
| 0.2 |
| 2 |
| 0.18 |
| 2 |
(2)向50mL0.18mol?L-1的AgNO3溶液中加入50mL0.18mol?L-1的盐酸,混合后两者浓度分别为c(Ag+)=
| 0.18 |
| 2 |
| 0.18 |
| 2 |
| 1.0×10-19 |
(3)向50ml0.18mol/L的AgNO3溶液中加入50ml0.2mol/L的盐酸,混合后两者浓度分别为c(Ag+)=
| 0.18 |
| 2 |
| 0.2 |
| 2 |
Ksp=c(Ag+)×C(Cl-)=1.0×10-19,则:c(Ag+)=
| 1.0×10 -19 |
| 0.01 |
沉淀生成后,氢离子浓度c=
| 0.2mol/L |
| 2 |
点评:本题考查溶液浓度的计算,本题难度不大,做题时注意判断两种物质的反应程度,再根据溶度积常数计算.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
下列解释实验事实的方程式不正确的是( )
| A、可用氯气进行自来水的杀菌消毒:Cl2+H2O═HCl+HClO |
| B、将“NO2球”浸泡在热水中,颜色变深:2NO2(g)═N2O4(g)△H<0 |
| C、在刻制印刷电路板时,用FeCl3溶液腐蚀铜箔:2Fe3++3Cu═2Fe+3Cu2+ |
| D、在KNO3和稀硫酸混合液中,铜片溶解:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O |


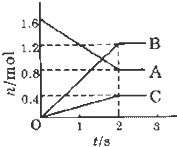 某温度下,在体积为5L的容器中,A、B、C三种物质物质的量随着时间变化的关系如图所示,则该反应的化学方程式为
某温度下,在体积为5L的容器中,A、B、C三种物质物质的量随着时间变化的关系如图所示,则该反应的化学方程式为