��Ŀ����
ʵʩ�Լ�����Դ�˷Ѻͽ��ͷ����ŷ�Ϊ�������ݵĽ��ܼ������ߣ���Ӧ��ȫ���������⡢������Դ��Լ�͡������Ѻ������ı�Ȼѡ������ҵ�ķ�չ������Ϲ��ҽ��ܼ��ŵ�����Ҫ����������ѧ֪ʶ������������⣺
��1����֪��
2SO2��g��+O2��g��?2SO3��g����H=-196.6kJ?mol-1
2NO��g��+O2��g��?2NO2��g����H=-113.0kJ?mol-1
��ӦNO2��g��+SO2��g��?SO3��g��+NO��g���ġ�H= ��
һ�������£���NO2��SO2�������1��2�����ܱ������з���������Ӧ��ƽ��ʱNO2��SO2�����Ϊ1��6����ƽ�ⳣ��K= ��
��2����֪��400��ʱ��N2��g��+3H2��g��?2NH3��g����H��0��K=0.5����400��ʱ����0.5L�ķ�Ӧ�����н��кϳɰ���Ӧ��һ��ʱ����N2��H2��NH3�����ʵ����ֱ�Ϊ2mol��1mol��2mol�����ʱ��ӦV��N2���� V��N2���������������=������ȷ������ʹ�ø÷�Ӧ�Ļ�ѧ��Ӧ���ʼӿ죬ͬʱʹƽ��ʱNH3������ٷ������ӣ��ɲ�ȡ����ȷ��ʩ�� ������ţ�
A����С�������ѹǿ B�������¶� C���Ӵ��� D��ʹ����Һ���������ϵ
E�����º��������£���Ͷ��N2��H2��NH3�����ʵ���2mol��1mol��2mol
��3���Լ״�Ϊȼ�ϵ����͵�أ���ɱ�������������Ϊȼ�ϵĴ�ͳȼ�ϵ�أ�Ŀǰ�õ��㷺���о�����ͼ��Ŀǰ�о��϶��һ�����������ȼ�ϵ�ع���ԭ��ʾ��ͼ��ͼ1��
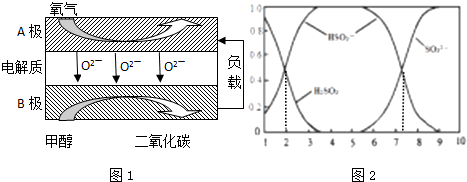
�ش��������⣺
��B��Ϊ��� �����缫��ӦʽΪ ��
�����ø�ȼ�ϵ������Դ����ʯī���缫���100mL 1mol/L������ͭ��Һ���������ռ���������������ʱ�����������ĵļ״������ʵ���Ϊ ��������λ��Ч���֣�
��4����SO2�ķ������ü�Һ�������գ�SO2��NaOH��Ӧ�����Һ��H2SO3��HSO3-��SO32-�����ʵ�������������ҺpH�Ĺ�ϵ��ͼ2��ʾ��
����˵����ȷ���� ������ĸ��ţ���
a��pH=8ʱ����Һ��c��HSO3-����c��SO32-��
b��pH=2ʱ����Һ��c��Na+��+c��H+��=c��H2SO3��+2c��SO32-��+c��OH-��
c����Һ�� c��SO32-��=c��HSO3-�� ʱ����c��H+����c��OH-��
d��Ϊ��þ����ܴ���NaHSO3���ɽ���Һ��pH������4��5���ң�
��1����֪��
2SO2��g��+O2��g��?2SO3��g����H=-196.6kJ?mol-1
2NO��g��+O2��g��?2NO2��g����H=-113.0kJ?mol-1
��ӦNO2��g��+SO2��g��?SO3��g��+NO��g���ġ�H=
һ�������£���NO2��SO2�������1��2�����ܱ������з���������Ӧ��ƽ��ʱNO2��SO2�����Ϊ1��6����ƽ�ⳣ��K=
��2����֪��400��ʱ��N2��g��+3H2��g��?2NH3��g����H��0��K=0.5����400��ʱ����0.5L�ķ�Ӧ�����н��кϳɰ���Ӧ��һ��ʱ����N2��H2��NH3�����ʵ����ֱ�Ϊ2mol��1mol��2mol�����ʱ��ӦV��N2����
A����С�������ѹǿ B�������¶� C���Ӵ��� D��ʹ����Һ���������ϵ
E�����º��������£���Ͷ��N2��H2��NH3�����ʵ���2mol��1mol��2mol
��3���Լ״�Ϊȼ�ϵ����͵�أ���ɱ�������������Ϊȼ�ϵĴ�ͳȼ�ϵ�أ�Ŀǰ�õ��㷺���о�����ͼ��Ŀǰ�о��϶��һ�����������ȼ�ϵ�ع���ԭ��ʾ��ͼ��ͼ1��

�ش��������⣺
��B�����
�����ø�ȼ�ϵ������Դ����ʯī���缫���100mL 1mol/L������ͭ��Һ���������ռ���������������ʱ�����������ĵļ״������ʵ���Ϊ
��4����SO2�ķ������ü�Һ�������գ�SO2��NaOH��Ӧ�����Һ��H2SO3��HSO3-��SO32-�����ʵ�������������ҺpH�Ĺ�ϵ��ͼ2��ʾ��
����˵����ȷ����
a��pH=8ʱ����Һ��c��HSO3-����c��SO32-��
b��pH=2ʱ����Һ��c��Na+��+c��H+��=c��H2SO3��+2c��SO32-��+c��OH-��
c����Һ�� c��SO32-��=c��HSO3-�� ʱ����c��H+����c��OH-��
d��Ϊ��þ����ܴ���NaHSO3���ɽ���Һ��pH������4��5���ң�
���㣺��ѧƽ���Ӱ������,�Ȼ�ѧ����ʽ,������ѧ��Դ�����༰�乤��ԭ��
ר�⣺�����������������
��������1�����ø�˹���������㷴Ӧ�ȣ����û�ѧƽ����������ȡ������������ж���ѧƽ�⣬�������η�����ƽ��ʱ��Ũ�������㻯ѧƽ�ⳣ����
��2������Ũ���̺�ƽ�ⳣ����С�Ƚ��жϷ�Ӧ���еķ�����Q=K����Ӧ�ﵽƽ�⣬Q��K����Ӧ������У�Q��K��Ӧ������У�ʹ�ø÷�Ӧ�Ļ�ѧ��Ӧ���ʼӿ죬ͬʱʹƽ��ʱNH3������ٷ������ӣ���Ҫ�ı����� ���㻯ѧ��Ӧ����������ƽ��������У�
��3��B������״�������������Ӧ��Ϊ��صĸ������ܷ�ӦʽΪ2CH3OH+3O2=2CO2+4H2O��������ӦʽΪ��O2+2e-=2O2-����ʽ����ɵø����缫��Ӧʽ��
��ʼ�η�����Ӧ��2Cu2++2H2O
2Cu+O2��+4H+��ͭ������ȫ�ŵ������Ӧ2H2O
2H2��+O2�����������ռ���������������ʱ���������������������ȣ���������Ϊxmol�����ݵ���ת���غ��з��̼��㣬�ٸ��ݵ���ת���غ�������ĵļ״�������
��4������ͼ2��֪��
a��pH=8ʱ����Һ��c��HSO3-����c��SO32-������a��ȷ��
b��pH=2ʱ��c��HSO3-��=c��H2SO3�����ٽ�ϵ���غ㣺c��Na+��+c��H+��=c��HSO3-��+2c��SO32-��+c��OH-�����ɵ���Һ��c��Na+��+c��H+��=c��H2SO3��+2c��SO32-��+c��OH-����
c����Һ�� c��SO32-��=c��HSO3-�� ʱ��PH��7����c��H+����c��OH-����
d��pH������4��5���ң���Ԫ�ؼ���ȫ����NaHSO3��ʽ���ڣ�
��2������Ũ���̺�ƽ�ⳣ����С�Ƚ��жϷ�Ӧ���еķ�����Q=K����Ӧ�ﵽƽ�⣬Q��K����Ӧ������У�Q��K��Ӧ������У�ʹ�ø÷�Ӧ�Ļ�ѧ��Ӧ���ʼӿ죬ͬʱʹƽ��ʱNH3������ٷ������ӣ���Ҫ�ı����� ���㻯ѧ��Ӧ����������ƽ��������У�
��3��B������״�������������Ӧ��Ϊ��صĸ������ܷ�ӦʽΪ2CH3OH+3O2=2CO2+4H2O��������ӦʽΪ��O2+2e-=2O2-����ʽ����ɵø����缫��Ӧʽ��
��ʼ�η�����Ӧ��2Cu2++2H2O
| ||
| ||
��4������ͼ2��֪��
a��pH=8ʱ����Һ��c��HSO3-����c��SO32-������a��ȷ��
b��pH=2ʱ��c��HSO3-��=c��H2SO3�����ٽ�ϵ���غ㣺c��Na+��+c��H+��=c��HSO3-��+2c��SO32-��+c��OH-�����ɵ���Һ��c��Na+��+c��H+��=c��H2SO3��+2c��SO32-��+c��OH-����
c����Һ�� c��SO32-��=c��HSO3-�� ʱ��PH��7����c��H+����c��OH-����
d��pH������4��5���ң���Ԫ�ؼ���ȫ����NaHSO3��ʽ���ڣ�
���
�⣺��1�����ݸ�˹���ɣ����ڶ�������ʽ�ߵ����������һ������ʽ��ӵã�2NO2+2SO2�T2SO3+2NO����H=-83.6 kJ?mol-1����NO2+SO2?SO3+NO����H=-41.8 kJ?mol-1��
NO2��g��+SO2��g��?SO3��g��+NO��g��
��ʼ���ʵ���� a 2a 0 0
ת�����ʵ���� x x x x
ƽ�����ʵ���� a-x 2a-x x x
��a-x������2a-x��=1��6����x=
a��
��ƽ�ⳣ��Ϊ=
=
��
�ʴ�Ϊ��-41.8��2.67��
��
��2��һ��ʱ���N2��H2��NH3�����ʵ����ֱ�Ϊ2mol/L��1mol/L��2mol/Lʱ��Qc=
=0.5�����Ը�״̬��ƽ��״̬�����淴Ӧ������ȣ��ʴ�Ϊ��=��
��ʹ�ø÷�Ӧ�Ļ�ѧ��Ӧ���ʼӿ죬ͬʱʹƽ��ʱNH3������ٷ������ӣ�
A����Ӧ�����������С�ķ�Ӧ����С�������ѹǿ����Ӧ��������ƽ��������У���A��ȷ��
B����Ӧ�Ƿ��ȷ�Ӧ�������¶ȣ���������ƽ��������У���B����
C���Ӵ����ı䷴Ӧ���ʣ����ı�ƽ�⣬��C����
D��ʹ����Һ�����ߣ�ƽ��������У���Ӧ���ʼ�С����D����
E�����º��������£���Ͷ��N2��H2��NH3�����ʵ���2mol��1mol��2mol���൱�ڼ�ѹ��ʹ�ø÷�Ӧ�Ļ�ѧ��Ӧ���ʼӿ죬ͬʱʹƽ��ʱNH3������ٷ������ӣ��ʴ�Ϊ��AE��
��3��B������״�������������Ӧ��Ϊ��صĸ������ܷ�ӦʽΪ2CH3OH+3O2=2CO2+4H2O��������ӦʽΪ��O2+2e-=2O2-����ʽ�����������ӦΪ��CH3OH+3O2--6e-=CO2+2H2O��
�ʴ�Ϊ��CH3OH+3O2--6e-=CO2+2H2O��
��2������ͭ�����ʵ���=0.1L��1mol/L=0.1mol����ʼ�η�����Ӧ��2Cu2++2H2O
2Cu+O2��+4H+��ͭ������ȫ�ŵ������Ӧ2H2O
2H2��+O2�����������ռ���������������ʱ���������������������ȣ���������Ϊxmol�����ݵ���ת���غ㣬��0.1mol��2+2x=4x�����x=0.1��
���ݵ���ת���غ㣬��֪���ĵļ״����ʵ���=
=0.067mol���ʴ�Ϊ��0.067mol����15�֣�
��4������ͼ2��֪��
a��pH=8ʱ����Һ��c��HSO3-����c��SO32-������a��ȷ��
b��pH=2ʱ��c��HSO3-��=c��H2SO3�����ٽ�ϵ���غ㣺c��Na+��+c��H+��=c��HSO3-��+2c��SO32-��+c��OH-�����ɵ���Һ��c��Na+��+c��H+��=c��H2SO3��+2c��SO32-��+c��OH-������b��ȷ��
c����Һ�� c��SO32-��=c��HSO3-�� ʱ��PH��7����c��H+����c��OH-������c����
d��Ϊ��þ����ܴ���NaHSO3���ɽ���Һ��pH������4��5���ң���d��ȷ����ѡabd��
NO2��g��+SO2��g��?SO3��g��+NO��g��
��ʼ���ʵ���� a 2a 0 0
ת�����ʵ���� x x x x
ƽ�����ʵ���� a-x 2a-x x x
��a-x������2a-x��=1��6����x=
| 4 |
| 5 |
��ƽ�ⳣ��Ϊ=
| x2 |
| (a-x)(2a-x) |
| 8 |
| 3 |
�ʴ�Ϊ��-41.8��2.67��
| 8 |
| 3 |
��2��һ��ʱ���N2��H2��NH3�����ʵ����ֱ�Ϊ2mol/L��1mol/L��2mol/Lʱ��Qc=
| 4��4 |
| 4��23 |
��ʹ�ø÷�Ӧ�Ļ�ѧ��Ӧ���ʼӿ죬ͬʱʹƽ��ʱNH3������ٷ������ӣ�
A����Ӧ�����������С�ķ�Ӧ����С�������ѹǿ����Ӧ��������ƽ��������У���A��ȷ��
B����Ӧ�Ƿ��ȷ�Ӧ�������¶ȣ���������ƽ��������У���B����
C���Ӵ����ı䷴Ӧ���ʣ����ı�ƽ�⣬��C����
D��ʹ����Һ�����ߣ�ƽ��������У���Ӧ���ʼ�С����D����
E�����º��������£���Ͷ��N2��H2��NH3�����ʵ���2mol��1mol��2mol���൱�ڼ�ѹ��ʹ�ø÷�Ӧ�Ļ�ѧ��Ӧ���ʼӿ죬ͬʱʹƽ��ʱNH3������ٷ������ӣ��ʴ�Ϊ��AE��
��3��B������״�������������Ӧ��Ϊ��صĸ������ܷ�ӦʽΪ2CH3OH+3O2=2CO2+4H2O��������ӦʽΪ��O2+2e-=2O2-����ʽ�����������ӦΪ��CH3OH+3O2--6e-=CO2+2H2O��
�ʴ�Ϊ��CH3OH+3O2--6e-=CO2+2H2O��
��2������ͭ�����ʵ���=0.1L��1mol/L=0.1mol����ʼ�η�����Ӧ��2Cu2++2H2O
| ||
| ||
���ݵ���ת���غ㣬��֪���ĵļ״����ʵ���=
| 0.1��4 |
| 6 |
��4������ͼ2��֪��
a��pH=8ʱ����Һ��c��HSO3-����c��SO32-������a��ȷ��
b��pH=2ʱ��c��HSO3-��=c��H2SO3�����ٽ�ϵ���غ㣺c��Na+��+c��H+��=c��HSO3-��+2c��SO32-��+c��OH-�����ɵ���Һ��c��Na+��+c��H+��=c��H2SO3��+2c��SO32-��+c��OH-������b��ȷ��
c����Һ�� c��SO32-��=c��HSO3-�� ʱ��PH��7����c��H+����c��OH-������c����
d��Ϊ��þ����ܴ���NaHSO3���ɽ���Һ��pH������4��5���ң���d��ȷ����ѡabd��
���������⿼���˻�ѧƽ���Ӱ�����ء�ƽ�ⳣ���ļ��㡢��˹���ɵ�Ӧ�á��绯ѧ����Һ������Ũ�ȴ�С�����⣬�ۺ��Խ�ǿ���Ѷ��еȣ�

��ϰ��ϵ�д�
�����Ŀ
����˵��������ǣ�������
| A�����й��ۼ��Ļ����ﲻһ���ǹ��ۻ����� |
| B���ڹ��ۻ�������һ�����й��ۼ� |
| C���������Ӽ��Ļ�����һ�������ӻ����� |
| D�����Ӽ������������ӽ�ϳɻ�����ľ������� |
����˵��������ǣ�������
A������ϵͳ�������� ������Ϊ3��3��4-�������� ������Ϊ3��3��4-�������� |
| B���Ҵ���������������������ñ���Na2CO3��Һ���� |
| C������ϩ������ԭ�ӿ��ܹ�ƽ�� |
D��1.0mol��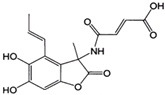 ��NaOH��Һ��Br2��Ӧʱ���ֱ���Ҫ����NaOH 5.0mol��Br2 3.0mol ��NaOH��Һ��Br2��Ӧʱ���ֱ���Ҫ����NaOH 5.0mol��Br2 3.0mol |
ҩ�ﱴŵ����������ˮ����Ͷ�������������һ�������·�Ӧ�Ƶã�

�й�������Ӧ��Ͳ����������ȷ���ǣ�������

�й�������Ӧ��Ͳ����������ȷ���ǣ�������
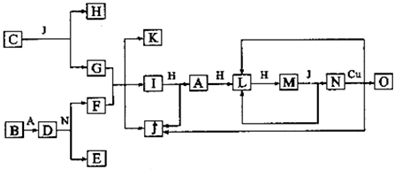
| A����̼�ĹǼܷ��࣬���������л�������ڷ����� |
| B������ˮ��������в���������̼ԭ�� |
| C���ں˴Ź��������У������������ӷ�����4���� |
| D����ŵ����������3�ֲ�ͬ���͵ĺ��������� |
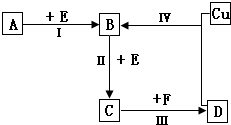 ������λ�ڶ����ڵ��������ڡ���������ķǽ���Ԫ��X��Y����֪��Ԫ������������ˮ�����Ϊǿ�ᣮ������ͼת����ϵ����Ӧ���������ֲ�������ȥ�����ش��������⣺
������λ�ڶ����ڵ��������ڡ���������ķǽ���Ԫ��X��Y����֪��Ԫ������������ˮ�����Ϊǿ�ᣮ������ͼת����ϵ����Ӧ���������ֲ�������ȥ�����ش��������⣺