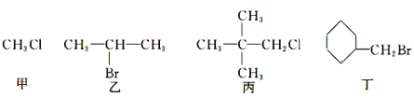
题目内容
【题目】莽草酸是一种合成治疗禽流感药物达菲的原料,鞣酸存在于苹果、生石榴等植物中。下列关于这两种有机化合物说法正确的是

A.两种酸与溴水反应现象相同
B.两种酸遇三氯化铁溶液都显色
C.鞣酸分子比莽草酸分子多两个碳碳双键
D.等物质的量的两种酸消耗NaOH物质的量不同
【答案】D
【解析】
A.莽草酸中的碳碳双键能与溴水发生加成反应使溴水褪色,鞣酸中酚羟基的邻(或对)位的氢原子可与溴水发生取代反应,生成不溶于水的溴代物,现象不相同,A错误;
B.莽草酸中不含酚羟基,不能与FeCl3发生显色反应,B错误;
C.鞣酸中不含碳碳双键,C错误;
D.莽草酸中只有-COOH能与烧碱(NaOH)溶液反应,而鞣酸中除羧基外,还有3个酚羟基能与烧碱溶液反应,故消耗NaOH的量不相同,D正确;
故选D。

【题目】25 ℃时,AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液。观察到的现象是先出现黄色沉淀,最终出现黑色沉淀。已知有关物质的溶度积Ksp(25 ℃)如下:
AgCl | AgI | Ag2S | |
Ksp(单位省略) | 1.8×10-10 | 1.5×10-16 | 6.3×10-50 |
下列叙述错误的是 ( )
A.沉淀转化的实质就是沉淀溶解平衡的移动
B.溶解度小的沉淀可以转化为溶解度更小的沉淀
C.AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶解程度相同
D.25 ℃时,在饱和AgCl、AgI、Ag2S溶液中,所含Ag+的浓度不同
【题目】工业制硫酸的反应原理主要有下列三个反应:
①FeS2(s)+O2(g)![]() Fe2O3(s)+SO2(g);ΔH1
Fe2O3(s)+SO2(g);ΔH1
②2SO2(g)+O2(g)![]() 2SO3(g); ΔH2
2SO3(g); ΔH2
③SO3+H2O=H2SO4
Ⅰ.(1)反应①配平后各物质系数分别为_____、______、_______、______。若每生成1molSO2时反应放热426.5kJ,则ΔH1=_______________。
(2)工业生产中将FeS2矿石粉碎后投入反应器中反应,这样做的目的是___________。
Ⅱ.下表是不同温度和压强下反应②中SO2的转化率
0.1Mp | 0.5Mp | 1Mp | 10Mp | |
400℃ | 99.2 | 99.6 | 99.7 | 99.9 |
500℃ | 93.5 | 96.9 | 97.8 | 99.3 |
600℃ | 73.7 | 85.8 | 89.5 | 96.4 |
(3)反应②是气体体积缩小的可逆反应,增大压强有利于提高原料转化率,但工业生产中该反应在常压下进行,采用常压生产条件的理由是_______________________。
(4)若原料气组成:SO2 7%,O211%,N2 82%,在温度和压强不变的条件下,混合气体体积变为原来的97.2%,则SO2的转化率为_________。
Ⅲ.尾气中的二氧化硫对环境造成污染,需要处理后才能排放。常用亚硫酸钠吸收法。
(5)Na2SO3溶液吸收SO2的离子方程式为________________________ ;
(6)常温下,当吸收至pH=6时,吸收液中相关离子浓度关系一定正确的是____(填序号)
A.c(Na+)+c(H+)>c(SO32-)+c(HSO3-)+c(OH-)
B.c(Na+)=c(SO32-)+c(HSO3-)+C(H2SO3)
C.c(Na+)>c(SO32-)>c(OH-)>c(H+)
D.水电离出c(OH-)=l×l0-8 mol·L-1