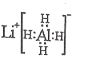��Ŀ����
����Ŀ����ҵ������ķ�Ӧԭ����Ҫ������������Ӧ��
��FeS2(s)+O2(g)![]() Fe2O3(s)+SO2(g)����H1
Fe2O3(s)+SO2(g)����H1
��2SO2(g)+O2(g)![]() 2SO3(g)�� ��H2
2SO3(g)�� ��H2
��SO3+H2O=H2SO4
��.(1)��Ӧ����ƽ�������ϵ���ֱ�Ϊ_____��______��_______��______����ÿ����1molSO2ʱ��Ӧ����426.5kJ������H1=_______________��
(2)��ҵ�����н�FeS2��ʯ�����Ͷ�뷴Ӧ���з�Ӧ����������Ŀ����___________��
��.�±��Dz�ͬ�¶Ⱥ�ѹǿ�·�Ӧ����SO2��ת����
0.1Mp | 0.5Mp | 1Mp | 10Mp | |
400�� | 99.2 | 99.6 | 99.7 | 99.9 |
500�� | 93.5 | 96.9 | 97.8 | 99.3 |
600�� | 73.7 | 85.8 | 89.5 | 96.4 |
(3)��Ӧ�������������С�Ŀ��淴Ӧ������ѹǿ���������ԭ��ת���ʣ�����ҵ�����и÷�Ӧ�ڳ�ѹ�½��У����ó�ѹ����������������_______________________��
(4)��ԭ������ɣ�SO2 7%��O211%��N2 82%�����¶Ⱥ�ѹǿ����������£�������������Ϊԭ����97.2%����SO2��ת����Ϊ_________��
��.β���еĶ�������Ի��������Ⱦ����Ҫ����������ŷš����������������շ���
(5)Na2SO3��Һ����SO2�����ӷ���ʽΪ________________________ ��
(6)�����£���������pH=6ʱ������Һ���������Ũ�ȹ�ϵһ����ȷ����____(�����)
A.c(Na+)+c(H+)>c(SO32-)+c(HSO3-)+c(OH-)
B.c(Na+)=c(SO32-)+c(HSO3-)+C(H2SO3)
C.c(Na+)>c(SO32-)>c(OH-)>c(H+)
D.ˮ�����c(OH-)=l��l0-8 mol��L-1
���𰸡�4 11 2 8 3412 kJ/mol ����Ӧ�Ӵ��������߷�Ӧ���ʣ�ԭ�Ϸ�Ӧ����� ��ѹ�����нϸߵ�ת���ʣ����ó�ѹ�����ɼ�����Դ���� 80% SO32-+SO2+H2O=2HSO3- AD
��������
(1)����������ԭ��Ӧ�е����غ㡢ԭ���غ���ƽ�����ʷ�Ӧ�ų��������뷴Ӧ�����ʶ��ٳ����ȣ��ݴ˼��㣻
(2)���ݹ������ʶԻ�ѧ��Ӧ���ʵ�Ӱ������жϣ�
(3)������ѹǿ��Ҫ�Ķ����ܺķ����жϣ�
(4)���ݷ�Ӧǰ�������������㷴Ӧ��SO2�����ʵ�����Ȼ�����ת���ʼ��㣻
(5)Na2SO3��SO2��H2O��Ӧ����NaHSO3���ݴ���д��Ӧ�����ӷ���ʽ��
(6)A.���ݵ���غ��жϣ�
B.���������غ��жϣ�
C.NaHSO3��Һ��HSO3-�ĵ���̶ȴ�����ˮ��̶ȣ�
D.ˮ�����������Ũ�ȵ�����Һ������������Ũ�ȣ�������Һ��pH����ˮ�����������Ũ�ȡ�
(1)�������Ӧ�У�FeԪ�ػ��ϼ��ɷ�ӦǰFeS2�е�+2�۱�Ϊ��Ӧ��Fe2O3�е�+3�ۣ����ϼ�����1�ۣ�SԪ�ػ��ϼ��ɷ�ӦǰFeS2�е�-1�۱�Ϊ��Ӧ��SO2�е�+4�ۣ����ϼ�����5��2=10�ۣ�FeS2������11�ۣ�OԪ�صĻ��ϼ��ɷ�ӦǰO2�е�0�۱�Ϊ��Ӧ��Fe2O3��SO2�е�-1�ۣ����ϼ۽���2��2=4�ۣ����ϼ�������С��������44������FeS2��ϵ����4��Fe2O3��ϵ����2��SO2��ϵ����8��O2��ϵ����11���ʸ÷�Ӧ��ƽ��Ļ�ѧ����ʽΪ4FeS2(s)+11O2(g)![]() 2Fe2O3(s)+8SO2(g)����ÿ����1molSO2ʱ��Ӧ����426.5kJ�����ڸ÷�Ӧ�ڲ���8molSO2���ų�������8��426.5kJ=3412kJ������H1=3412kJ/mol��
2Fe2O3(s)+8SO2(g)����ÿ����1molSO2ʱ��Ӧ����426.5kJ�����ڸ÷�Ӧ�ڲ���8molSO2���ų�������8��426.5kJ=3412kJ������H1=3412kJ/mol��
(2)��ҵ�����н�FeS2��ʯ�����Ͷ�뷴Ӧ���з�Ӧ��������Ŀ��������Ӧ�Ӵ��������߷�Ӧ���ʣ�ԭ�Ϸ�Ӧ����֣�
(3)��Ӧ�������������С�Ŀ��淴Ӧ������ѹǿ���������ԭ��ת���ʣ�����ҵ�����и÷�Ӧ�ڳ�ѹ�½��У����ó�ѹ���������������dz�ѹ�����нϸߵ�ת���ʣ����ó�ѹ�����ɼ�����Դ���ģ�����Ͷ�ʳɱ���
(4)��Ӧ����ʽΪ��2SO2(g)+O2(g)![]() 2SO3(g)�����ݷ���ʽ��֪��ÿ��2���SO2��Ӧ��������1�����O2����Ӧ����2�����SO3����Ӧ�����������С1���������ԭ ���������100L����SO2 7L��O211L��N2 82L�����ڷ�Ӧ�����������ԭ����97.2%����Ӧ���������Ϊ97.2L�����������С��2.8L��˵��SO2��Ӧ��5.6L�����SO2��Ӧת����Ϊ(5.6L��7L)��100%=80%��
2SO3(g)�����ݷ���ʽ��֪��ÿ��2���SO2��Ӧ��������1�����O2����Ӧ����2�����SO3����Ӧ�����������С1���������ԭ ���������100L����SO2 7L��O211L��N2 82L�����ڷ�Ӧ�����������ԭ����97.2%����Ӧ���������Ϊ97.2L�����������С��2.8L��˵��SO2��Ӧ��5.6L�����SO2��Ӧת����Ϊ(5.6L��7L)��100%=80%��
(5)Na2SO3��SO2��H2O��Ӧ����NaHSO3����Ӧ�����ӷ���ʽΪ��SO32-+SO2+H2O=2HSO3-��
(6)A.���ݵ���غ㣺c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-)������c(Na+)+c(H+)>c(SO32-)+c(HSO3-)+c(OH-)��A��ȷ��
B.��ҺpH����6������ȷ����Һ�ijɷ���NaHSO3����NaHSO3������Na2SO3�Ļ����Һ����˲���ȷ����Һ��c(Na+)�뺬��SԪ�ص�����Ũ�ȹ�ϵ��B����
C.�����£���������pH=6ʱ��˵����Һ��c(H+)>c(OH-)��C����
D.���ڷ�Ӧ����Һ��pH=6����c(H+)=10-6mol/L������ˮ�����ӻ�������֪c(OH-)= l��10-14mol2/L2��l��10-6mol/L= l��10-8mol/L��ˮ�����������Ũ�ȵ�����Һ������������Ũ�ȣ�������Һ��ˮ�����������Ũ��c(H+)= c(OH-)= l��10-8mol/L��D��ȷ��
�ʺ���ѡ����AD��

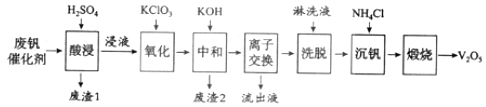
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ���Թ�����Ϊ���������������![]() �ǽӴ�����������Ĵ������ӷϷ������л���
�ǽӴ�����������Ĵ������ӷϷ������л���![]() �ȱ�����Ⱦ��������������Դ�ۺ����á��Ϸ���������Ҫ�ɷ�Ϊ��
�ȱ�����Ⱦ��������������Դ�ۺ����á��Ϸ���������Ҫ�ɷ�Ϊ��
���� |
|
|
|
|
|
|
�������� |
|
|
|
|
|
|
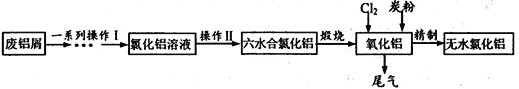
������һ�ַϷ��������չ���·�ߣ�
�ش��������⣺
![]() ������������һ�ִ������ɽ�
������������һ�ִ������ɽ�![]() ת��Ϊ
ת��Ϊ![]() ����д���÷�Ӧ�Ļ�ѧ����ʽ______��
����д���÷�Ӧ�Ļ�ѧ����ʽ______��
![]() �������ʱ
�������ʱ![]() ת��Ϊ
ת��Ϊ![]() ����Ӧ�����ӷ���ʽΪ______��ͬʱ
����Ӧ�����ӷ���ʽΪ______��ͬʱ![]() ת��
ת��![]() ������1������Ҫ�ɷ���______��
������1������Ҫ�ɷ���______��
![]() ������������ʹ3mol��
������������ʹ3mol��![]() ��Ϊ
��Ϊ![]() ������Ҫ������
������Ҫ������![]() ����Ϊ______mol��
����Ϊ______mol��
![]() ���к�������֮һ��ʹ����
���к�������֮һ��ʹ����![]() ��ʽ��������Һ�С�������2���к���______��
��ʽ��������Һ�С�������2���к���______��
![]() ������Һ����������������______��
������Һ����������������______��
![]() ���������õ�ƫ�����
���������õ�ƫ�����![]() ������д�����������з�����Ӧ�Ļ�ѧ����ʽ______��
������д�����������з�����Ӧ�Ļ�ѧ����ʽ______��