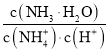题目内容
【题目】N元素的单质及其化合物之间的转化关系如图所示:
![]()
回答下列问题:
(1)N元素在元素周期表中的位置为__________,画出N原子结构示意图_________。
(2)工业上用氮气和氢气合成氨气,请写出NH3的电子式_____________。
(3)实验室可以利用氢氧化钙固体和氯化铵固体制备氨气,请写出该反应的化学方程式___________
【答案】第二周期第ⅤA族 ![]()
![]() 2NH4Cl+Ca(OH)2
2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
【解析】
(1)N元素为7号元素,先画出其原子结构示意图,根据其核外电子层数和最外层电子数,便可确定其在周期表中的位置。
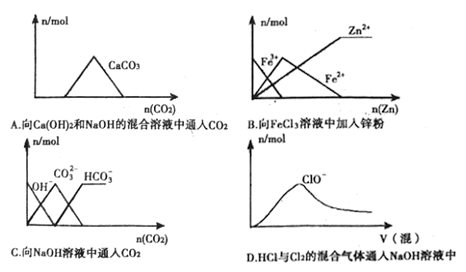
(2) NH3中N、H原子间各形成1对共用电子,另外,N原子还存在1对孤对电子。
(3)氢氧化钙固体和氯化铵固体在加热条件下发生复分解反应,生成氯化钙、氨气和水。
(1)N元素为7号元素,先画出其原子结构示意图为![]() ,根据其核外电子层数和最外层电子数,便可确定其位于周期表中的第二周期第ⅤA族。答案为:第二周期第ⅤA族;
,根据其核外电子层数和最外层电子数,便可确定其位于周期表中的第二周期第ⅤA族。答案为:第二周期第ⅤA族;![]() ;
;
(2) NH3中N、H原子间各形成1对共用电子,另外,N原子还存在1对孤对电子,于是得出其电子式为![]() 。答案为:
。答案为:![]() ;
;
(3)氢氧化钙固体和氯化铵固体在加热条件下发生复分解反应,生成氯化钙、氨气和水,发生反应的化学方程式为2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O。答案为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O。答案为:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O。
CaCl2+2NH3↑+2H2O。

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案【题目】将气体A、B置于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g)![]() 2C(g)+2D(g),反应进行到10 s末,测得A的物质的量为1.8 mol, B的物质的量为0.6 mol,C的物质的量为0.8 mol,则:
2C(g)+2D(g),反应进行到10 s末,测得A的物质的量为1.8 mol, B的物质的量为0.6 mol,C的物质的量为0.8 mol,则:
(1)用C表示10 s内反应的平均反应速率为__________;
(2)反应前A的物质的量浓度是__________;
(3)10 s末,生成物D的浓度为________;
(4)若改变下列条件,生成D的速率如何变化(用“增大”“减小”或“不变”填空)。
编号 | 改变的条件 | 生成D的速率 |
① | 降低温度 | _______ |
② | 增大A的浓度 | _______ |
③ | 使用催化剂 | _______ |
④ | 恒容下充入Ne(不参与体系反应) | _______ |