题目内容
19.表是元素周期表的一部分,回答下列问题:| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ⑪ | ⑫ |
(2)在这些元素中,Na(用元素符号填写,下同)是最活泼的金属元素;F是最活泼的非
金属元素.
(3)这些元素的最高价氧化物的对应水化物中HClO4酸性最强;NaOH碱性最强;能形成两性氢氧化物的元素是Al.
(4)比较⑤与⑥的化学性质,Na更活泼.
分析 (1)由元素在周期表中位置,可知①为C、②为N、③为O、④为F、⑤为Na、⑥为Mg、⑦为Al、⑧为Si、⑨为P、⑩为S、⑪为Cl、⑫为Ar.
(2)同周期从左至右元素金属性减弱、非金属性增强,同主族自上而下元素金属性增强、非金属性减弱;
(3)高氯酸的酸性最强,上述元素中Na的金属性最强,故氢氧化钠碱性最强,氢氧化铝属于两性氢氧化物;
(4)同周期从左至右金属活泼性逐渐减弱.
解答 解:(1)由元素在周期表中位置,可知①为C、②为N、③为O、④为F、⑤为Na、⑥为Mg、⑦为Al、⑧为Si、⑨为P、⑩为S、⑪为Cl、⑫为Ar,
故答案为:碳;氮;Si;P;
(2)同周期从左至右金属性减弱、非金属性增强,同主族自上而下金属性增强、非金属性减弱,故最活泼金属为Na,最活泼非金属为F,
故答案为:Na;F;
(3)F无最高正价,最高价含氧酸中酸性最强是HClO4,Na的金属性最强,故NaOH的碱性最强,Al元素的氢氧化物即氢氧化铝属于两性氢氧化物,
故答案为:HClO4;NaOH;Al;
(4)同周期从左至右金属活泼性逐渐减弱,则活泼性:Na>Mg,
故答案为:Na.
点评 本题考查位置、结构、性质的关系,为高频考点,把握元素的位置推断元素及元素化合物知识为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.工业上常用NaHSO3处理含Cr2O72-的废液,反应的离子方程式为:5H++Cr2O72-+3HSO3-→2Cr3++3SO42-+4H2O
下列判断错误的是( )
下列判断错误的是( )
| A. | 氧化产物是SO42- | |
| B. | 氧化剂与还原剂的物质的量之比是1:3 | |
| C. | Cr2O72-表现了氧化性 | |
| D. | 还原1molCr2O72-,电子转移3mol |
10.五种固体物质 A、B、C、D、E 由下表中不同的阴阳离子组成,它们均易溶于水.
分别取它们的水溶液进行实验,结果如下:
①A 溶液与 C 溶液混合后产生蓝色沉淀,向该沉淀中加入足量稀 HNO3,沉淀部分溶解,剩余 白色固体;
②B 溶液与 E 溶液混合后产生红褐色沉淀,同时产生大量气体;
③少量 C 溶液与 D 溶液混合后产生白色沉淀,过量 C 溶液与 D 溶液混合后无现象;
④B 溶液与 D 溶液混合后无现象;
⑤将 38.4g Cu 片投入装有足量 D 溶液的试管中,Cu 片不溶解,再滴加 1.6mol/L 稀 H2SO4,Cu 逐渐溶解,管口附近有红棕色气体出现.
(1)据此推断 A 的化学式为:ACuSO4;BFeCl3
(2)写出过量 C 与 D 发生反应的离子方程式Al3++4OH-=AlO2-+2H2O.
(3)B 溶液中滴入石蕊试液,现象是溶液变红,原因是Fe3++3H2O?Fe(OH)3+3H+(用离子方程式说明)
分别取它们的水溶液进行实验,结果如下:
| 阳离子 | Na+ | Al3+ | Fe3+ | Cu2+ | Ba2+ |
| 阴离子 | OH- | Cl- | CO32- | NO3- | SO42- |
②B 溶液与 E 溶液混合后产生红褐色沉淀,同时产生大量气体;
③少量 C 溶液与 D 溶液混合后产生白色沉淀,过量 C 溶液与 D 溶液混合后无现象;
④B 溶液与 D 溶液混合后无现象;
⑤将 38.4g Cu 片投入装有足量 D 溶液的试管中,Cu 片不溶解,再滴加 1.6mol/L 稀 H2SO4,Cu 逐渐溶解,管口附近有红棕色气体出现.
(1)据此推断 A 的化学式为:ACuSO4;BFeCl3
(2)写出过量 C 与 D 发生反应的离子方程式Al3++4OH-=AlO2-+2H2O.
(3)B 溶液中滴入石蕊试液,现象是溶液变红,原因是Fe3++3H2O?Fe(OH)3+3H+(用离子方程式说明)
7.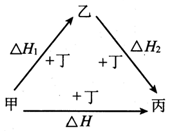 甲、乙、丙、丁四种物质在一 定条件下的转化关系如图所示,当乙作为反应物且与甲的物质的量相等时,△H=△H1+△H2.则甲、丙可能是( )
甲、乙、丙、丁四种物质在一 定条件下的转化关系如图所示,当乙作为反应物且与甲的物质的量相等时,△H=△H1+△H2.则甲、丙可能是( )
 甲、乙、丙、丁四种物质在一 定条件下的转化关系如图所示,当乙作为反应物且与甲的物质的量相等时,△H=△H1+△H2.则甲、丙可能是( )
甲、乙、丙、丁四种物质在一 定条件下的转化关系如图所示,当乙作为反应物且与甲的物质的量相等时,△H=△H1+△H2.则甲、丙可能是( )| A. | S、SO3 | B. | AlCl3、NaAlO2 | C. | Na、Na2O2 | D. | NaOH、Na2CO3 |
14.某水溶液中含有以下离子中的若干种:K+、Cl-、Ca2+、Zn2+、CO32-、SO42-,现取两份溶液各100mL分别进行如下实验:
①第一份加入AgNO3溶液有沉淀产生
②第二份加足量BaCl2溶液后,得沉淀物6.63g,经足量硝酸洗涤、干燥后,沉淀质量为4.66g;在所得滤液中加入AgNO3溶液有沉淀产生
根据上述实验,以下有关原溶液的论断不正确的是( )
①第一份加入AgNO3溶液有沉淀产生
②第二份加足量BaCl2溶液后,得沉淀物6.63g,经足量硝酸洗涤、干燥后,沉淀质量为4.66g;在所得滤液中加入AgNO3溶液有沉淀产生
根据上述实验,以下有关原溶液的论断不正确的是( )
| A. | Cl-一定存在 | |
| B. | CO32-和SO42-一定存在,且二者的个数比为1:2 | |
| C. | Zn2+和Ca2+一定不存在 | |
| D. | 100mL溶液中K+的质量不小于2.34g |
8.据有关报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程.反应过程如图:下列说法中正确的是( )
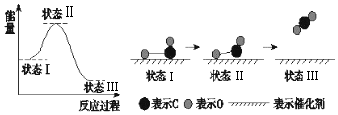

| A. | 状态Ⅰ→状态Ⅲ是放热过程 | |
| B. | 该过程中,CO先断键形成C和O,再生成CO2 | |
| C. | 状态Ⅰ→状态Ⅲ表示CO和O2反应,生成了CO2 | |
| D. | 状态Ⅰ→状态Ⅱ表示催化剂对反应没有起作用 |