��Ŀ����
8��A��J�ֱ��ʾ��ѧ��ѧ�г�����һ�����ʣ�����֮�����ϵ��ͼ��ʾ�����ַ�Ӧ�������û���г���������֪GΪ����Ԫ�صĹ�̬�����A��B��C��D��E��F���������о���ͬһ��Ԫ��M��
����д���пհף�
��1��A��B��C��D��E��F��������������ͬһ��Ԫ�������ڱ���λ���ǵ�4���ڢ��壮
��2������C��Һ�������ӷ�����ȡ����C��Һ�μ�KSCN����Һ���Ժ�ɫ���ټ���ˮ����Һ�ʺ�ɫ��֤����Fe2+��д�������������ۣ���
��3��д����Ӧ�ٵĻ�ѧ����ʽ��8Al+3Fe3O4$\frac{\underline{\;����\;}}{\;}$4Al2O3+9Fe��
��4��д����Ӧ�ܵ����ӷ���ʽ��2Al+2H2O+2OH-=2AlO2-+3H2����
��5��д����Ӧ�Ļ�ѧ����ʽ��4Fe��OH��2+O2+2H2O=4Fe��OH��3��
��6���������仯�Ƕȿ�����Ӧ�٢ڢ��У����ڡ�H��0�ķ�Ӧ�Ǣ٢ڣ�����ţ���
��7����amol MBr����Һ������ʵ���Cl2��ַ�Ӧ�����ӷ���ʽΪ2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-���˷�Ӧת�Ƶ��ӵ���ĿΪ2aNA��
���� GΪ����Ԫ�صĹ�̬��������G�õ�I��H��G�ܺ�����������Һ��Ӧ����J����ҵ���õ���������ķ���ұ��������G��Al2O3��I�ܺ�����������Һ��Ӧ����J����I��Al��J��NaAlO2��H��O2��Al��B���ڸ����·�Ӧ����A��A����������ȼ������B�����ڸ������ܷ������ȷ�Ӧ����B�ǽ��������A�ǽ������ʣ�B�����ᷴӦ����C��D��C���������Ʒ�Ӧ����E��D�Ͱ�ˮ��Ӧ����F��E�ڿ����з�Ӧ����F��˵��E���ȶ����ױ�������������A��B��C��D��E��F���������о���ͬһ��Ԫ�أ���A��Fe��BΪFe3O4��CΪFeCl2��DΪFeCl3��EΪFe��OH��2��FΪFe��OH��3����϶�Ӧ���ʡ�����������ʽ����⣮
��� �⣺��1��A��B��C��D��E��F����������������ͬһ��Ԫ����FeԪ�أ���Ԫ��λ�ڵ������ڵڢ��壬�ʴ�Ϊ����4���ڢ��壻
��2��CΪFeCl2������FeCl2��Һ�������ӷ����ǣ�ȡ����C��Һ�μ�KSCN����Һ���Ժ�ɫ���ټ���ˮ����Һ�ʺ�ɫ��֤����Fe2+��
�ʴ�Ϊ��ȡ����C��Һ�μ�KSCN����Һ���Ժ�ɫ���ټ���ˮ����Һ�ʺ�ɫ��֤����Fe2+��
��3����Ӧ���Ǹ���������������������Ӧ������������������Ӧ����ʽΪ��8Al+3Fe3O4$\frac{\underline{\;����\;}}{\;}$4Al2O3+9Fe���ʴ�Ϊ��8Al+3Fe3O4$\frac{\underline{\;����\;}}{\;}$4Al2O3+9Fe��
��4����Ӧ���������������Ʒ�Ӧ����ƫ�����ƺ���������Ӧ���ӷ���ʽΪ��2Al+2H2O+2OH-=2AlO2-+3H2�����ʴ�Ϊ��2Al+2H2O+2OH-=2AlO2-+3H2����
��5����Ӧ�����������������ȶ��ױ�������������������������Ӧ����ʽΪ��4Fe��OH��2+O2+2H2O=4Fe��OH��3���ʴ�Ϊ��4Fe��OH��2+O2+2H2O=4Fe��OH��3��
��6����H��O�ķ�ӦΪ���ȷ�Ӧ����Ϊ���ȷ�Ӧ����Ϊȼ�շ�Ӧ����Ϊ�����ķ��ȷ�Ӧ����Ϊ��ⷴӦ��Ϊ���ȷ�Ӧ���ʴ�Ϊ���٢ڣ�
��7����amol MBr��FeBr2����Һ������ʵ���Cl2�����ڻ�ԭ��Fe2+��Br-����������������Fe2+����Ӧ�����ӷ���ʽΪ2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-������amol Fe2+��amol Br-�����Դ˷�Ӧת�Ƶ��ӵ���ĿΪ2aNA���ʴ�Ϊ��2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-��2aNA��
���� ���⿼��������ƶϣ���Ŀ�Ѷ��еȣ�ע��������ʵ����ʺ͵��ͷ�Ӧ��������ƶϣ�ע����������Ԫ�ػ��������ʣ�

 Сѧ��ĩ���Ծ�ϵ�д�
Сѧ��ĩ���Ծ�ϵ�д�| A�� | ���³�ѹ�£�1.7g NH3�����ĵ�����Ϊ0.8NA | |
| B�� | ��״���£�11.2L SO2��������ԭ����Ϊ1.5NA | |
| C�� | 1mol Fe��������ϡ���ᷴӦ��ת�Ƶĵ�������Ϊ3NA | |
| D�� | 0.1mol•L-1��Na2CO3��Һ�к��е���������Ϊ0.2NA |
 �й�������ŵ����2020�꣬��λGDP������̼�ŷű�2005���½�40%��50%��
�й�������ŵ����2020�꣬��λGDP������̼�ŷű�2005���½�40%��50%����1����Ч��̼���ֶ�֮һ�ǽ��ܣ��������ⷽ������ܵ���C��
A�����ˮ���⣺2H2O$\frac{\underline{\;���\;}}{\;}$2H2��+O2��
B������ʹˮ�ֽ����⣺2H2O$\frac{\underline{\;����\;}}{\;}$2H2��+O2��
C��̫������ֽ�ˮ���⣺2H2O$\frac{\underline{\;\;\;TiO_{2}\;\;\;}}{̫����}$2H2��+O2��
D����Ȼ�����⣺CH4+H2O$\frac{\underline{\;����\;}}{\;}$CO+3H2
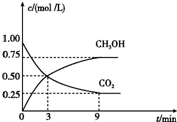
��2��CO2��ת�����л���ʵ��̼ѭ���������Ϊ1L ���ܱ������У�����1mol CO2��3mol H2��һ�������·�Ӧ��CO2��g��+3H2��g��?CH3OH��g��+H2O��g����H=-49.0kJ/mol�����CO2��CH3OH��g����Ũ����ʱ��仯��ͼ��ʾ��
�ٴ�3min��9min��v��H2��=0.125mol/��L•min����
����˵��������Ӧ�ﵽƽ��״̬����D�����ţ���
A����Ӧ��CO2��CH3OH�����ʵ���Ũ��֮��Ϊ1��1����ͼ�н���㣩
B�����������ܶȲ���ʱ��ı仯���仯
C����λʱ��������3mol H2��ͬʱ����1mol H2O
D��CO2����������ڻ�������б��ֲ���
��3����ҵ�ϣ�CH3OHҲ����CO��H2�ϳɣ��ο��ϳɷ�ӦCO��g��+2H2��g��?CH3OH��g����ƽ�ⳣ����
| �¶�/�� | 0 | 100 | 200 | 300 | 400 |
| ƽ�ⳣ�� | 667 | 13 | 1.9��10-2 | 2.4��10-4 | 1��10-5 |
A���÷�Ӧ����Ӧ�Ƿ��ȷ�Ӧ
B���÷�Ӧ�������¶�ʱ��CH3OH��g�������������С��˵��v����CH3OH����С��v����CH3OH������
C����T��ʱ��1L�ܱ������У�Ͷ��0.1mol CO��0.2mol H2���ﵽƽ��ʱ��COת����Ϊ50%�����ʱ��ƽ�ⳣ��Ϊ100
D����ҵ�ϲ����Ըߵ�ѹǿ��5Mpa����250�棬����Ϊ�������£�ԭ����ת������ߣ�
| A�� |  ��1 LŨ�Ⱦ�Ϊ0.1 mol•L-1��Ba��OH��2��NaAlO2���Һ�м���0.1 mol•L-1ϡ���� | |
| B�� |  ��1 L����0.1 mol•L-1 AlCl3��0.3 mol•L-1 NH4Cl�Ļ��Һ�м���0.1 mol•L-1 NaOH��Һ | |
| C�� |  ���ռ���Һ�μ�������Һ | |
| D�� |  ��AlCl3��Һ�μӹ�����ˮ |
| A�� | w=$\frac{36.5a}{��36.5a+22400��}$ | B�� | w=$\frac{36.5c}{1000b}$ | ||
| C�� | C=$\frac{1000ab}{��36.5a+22400��}$ | D�� | b=$\frac{��36.5a+22400��}{��a+1��}$ |
| A�� | ������أ�K2FeO4����һ������Ч�����ˮ������������ɱ���������ܾ�ˮ | |
| B�� | ���⻯ѧ���������������ն������γɶ��뵪���������й� | |
| C�� | ��SO2Ư��ֽ���Ͳ�ñ�裬�ù���������SO2�������� | |
| D�� | �ߴ��ȵĶ�������㷺�����������ά�����ά��ǿ��ᡰ��·�� |
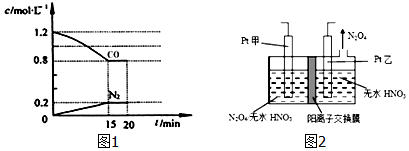
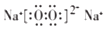 ���õ���ʽ��ʾ����
���õ���ʽ��ʾ���� ��
��