题目内容
8.具有下列电子层结构的原子,则下列有关比较中正确的是( )①3p轨道上只有一对成对电子的原子
②外围电子构型为2s22p5的原子
③其3p轨道为半充满的原子
④正三价的阳离子结构与氖相同的原子.
| A. | 第一电离能:②>③>①>④ | B. | 原子半径:④>③>②>① | ||
| C. | 电负性:②>③>①>④ | D. | 最高正化合价:②>③>①>④ |
分析 ①3p轨道上只有一对成对电子的原子,则该元素为S;
②外围电子构型为2s22p5的原子,则该元素为F;
③其3p轨道为半充满的原子,则该元素为P;
④正三价的阳离子结构与氖相同的原子,即失去3个电子后还有10个电子,所以原子中含有13个电子,即为Al元素;
结合元素周期律分析.
解答 解:①3p轨道上只有一对成对电子的原子,则该元素为S;
②外围电子构型为2s22p5的原子,则该元素为F;
③其3p轨道为半充满的原子,则该元素为P;
④正三价的阳离子结构与氖相同的原子,即失去3个电子后还有10个电子,所以原子中含有13个电子,即为Al元素;
A.不同周期中非金属性越强,第一电离能越大,同周期中从左到右第一电离能增大,但是第VA族大于第VIA族,所以第一电离能:F>P>S>Al,即:②>③>①>④,故A正确;
B.电子层越多,半径越大,电子层相同时,原子序数越大,半径越小,所以原子半径:Al>P>S>F,即:④>③>①>②,故B错误;
C.元素的非金属性越强,则电负性越强,所以电负性:F>S>P>Al,即:②>①>③>④,故C错误;
D.最高正化合价等于最外层电子数,F没有最高正价,所以S>P>Al>F,即:①>③>④>②,故D错误.
故选A.
点评 本题考查了元素的推断、核外电子排布、第一电离能比较等,侧重于基础知识点考查,难度不大,明确原子的电子排布是解题的关键.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
18.以下转化不能通过一步反应实现的是( )
| A. | Al2O3→Al(OH)3 | B. | SiO2→SiF4 | C. | Fe→FeCl2 | D. | Na→NaOH |
19.在11.2g铁和铜组成的合金中加入过量的硝酸溶液,合金完全溶解,同时生成气体X,再向所得溶液中加入足量的NaOH溶液,生成21.4g沉淀,则下列表示X组成的选项中合理的是( )
| A. | 0.3mol NO2 | B. | 0.3mol NO、0.1mol NO2 | ||
| C. | 0.6mol NO | D. | 0.3mol NO2、0.1mol NO |
3.在一定温度下的固定容积的密闭容器中,当下列物理量不再变化时,表明反应:A(s)+2B(g)?C(g)+D(g)已达平衡的是( )
| A. | 混合气体的压强 | B. | 气体的总物质的量 | ||
| C. | 消耗1摩尔A同时生成1摩尔D | D. | 混合气体的密度 |
13.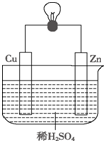 如图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,做了如下记录,其中描述合理的是( )
如图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,做了如下记录,其中描述合理的是( )
①Zn为正极,Cu为负极;
②H+向负极移动;
③电子流动方向:从Zn经外电路流向Cu;
④Cu极上有H2产生;
⑤正极的电极反应式为:Zn-2e-═Zn2+
⑥若有1mol电子流过导线,则产生H2为0.5mol.
 如图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,做了如下记录,其中描述合理的是( )
如图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,做了如下记录,其中描述合理的是( )①Zn为正极,Cu为负极;
②H+向负极移动;
③电子流动方向:从Zn经外电路流向Cu;
④Cu极上有H2产生;
⑤正极的电极反应式为:Zn-2e-═Zn2+
⑥若有1mol电子流过导线,则产生H2为0.5mol.
| A. | ①②③ | B. | ③④⑥ | C. | ④⑤⑥ | D. | ②③④ |
17.化学式为C5H12O且能与钠反应的同分异构体有( )
| A. | 6种 | B. | 7种 | C. | 8种 | D. | 9种 |
18.下列混合物可以用分液漏斗分离的是( )
| A. | 溴乙烷和水 | B. | 汽油和苯 | C. | 乙醇和水 | D. | 溴苯和苯 |
 2NH3(g)△H=-92kJ•mol-1.
2NH3(g)△H=-92kJ•mol-1. 已知A~G是几种烃分子的球棍模型,据此回答下列问题:
已知A~G是几种烃分子的球棍模型,据此回答下列问题: .
. .
.