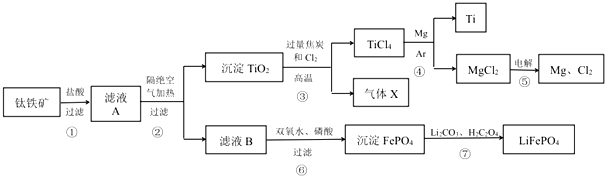
题目内容
16.多晶硅(硅单质的一种)被称为“微电子大厦的基石”,制备中副产物以SiCl4为主,它对环境污染很大,能遇水强烈水解,放出大量的热.研究人员利用SiCl4水解生成的盐酸和钡矿粉(主要成份为BaCO3,且含有少量钙、铁、镁离子)制备BaCl2•2H2O,工艺流程如下.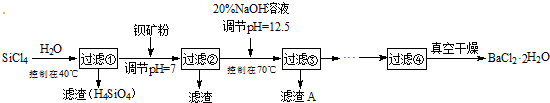
已知25℃时,Fe3+、Ca2+、Mg2+完全沉淀的pH分别是:3.4、13.1、12.4
(1)已知:SiCl4(s)+H2(g)═SiHCl3(s)+HCl(g)△H1=47kJ•mol-1
SiHCl3(s)+H2(g)═Si(s)+3HCl(g)△H2=189kJ•mol-1
则由SiCl4制备硅的热化学方程式为SiCl4(s)+2H2(g)=Si(s)+4HCl(g)△H=+236 kJ•mol-1.
(2)加钡矿粉时生成BaCl2的离子反应方程式是BaCO3+2H+=Ba2++CO2↑+H2O.
(3)加20% NaOH调节pH=12.5,得到滤渣A的主要成分是Mg(OH)2、Ca(OH)2,
控制温度70℃的目的是让钙离子沉淀完全.
(4)BaCl2滤液经蒸发浓缩、降温结晶、过滤,再经真空干燥后得到BaCl2•2H2O.实验室中蒸发浓缩用到的含硅酸盐的仪器有3种.
分析 控制温度40°C,四氯化硅发生水解生成原硅酸和氯化氢,过滤得到盐酸溶液,加入钡矿粉主要成分为BaCO3,且含有钙、铁、镁等离子,调节溶液pH=7,使BaCO3转化为BaCl2,同时使Fe3+完全沉淀,过滤得到滤渣为氢氧化铁,滤液加入氢氧化钠溶液调节溶液pH=12.5,控制70°C,得到氢氧化镁、氢氧化钙沉淀,过滤得到滤液为氯化钡溶液蒸发浓缩,冷却结晶,过滤洗涤得到氯化钡晶体;
(1)已知:①SiCl4(s)+H2(g)═SiHCl3(s)+HCl(g)△H1=47kJ•mol-1
②SiHCl3(s)+H2(g)═Si(s)+3HCl(g)△H2=189kJ•mol-1
根据盖斯定律,①+②可得:SiCl4(s)+2H2(g)=Si(s)+4HCl(g);
(2)碳酸钡与盐酸反应生成氯化钡、二氧化碳与水;
(3)滤渣A的主要成分是氢氧化镁、氢氧化钙;温度越高,Ca(OH)2溶解度越小;
(4)蒸发浓缩用到的含硅酸盐的仪器有:蒸发皿、酒精灯、玻璃棒.
解答 解:控制温度40°C,四氯化硅发生水解生成原硅酸和氯化氢,过滤得到盐酸溶液,加入钡矿粉主要成分为BaCO3,且含有钙、铁、镁等离子,调节溶液pH=7,使BaCO3转化为BaCl2,同时使Fe3+完全沉淀,过滤得到滤渣为氢氧化铁,滤液加入氢氧化钠溶液调节溶液pH=12.5,控制70°C,得到氢氧化镁、氢氧化钙沉淀,过滤得到滤液为氯化钡溶液蒸发浓缩,冷却结晶,过滤洗涤得到氯化钡晶体;
(1)已知:①SiCl4(s)+H2(g)═SiHCl3(s)+HCl(g)△H1=47kJ•mol-1
②SiHCl3(s)+H2(g)═Si(s)+3HCl(g)△H2=189kJ•mol-1
根据盖斯定律,①+②可得:SiCl4(s)+2H2(g)=Si(s)+4HCl(g)△H=+236 kJ•mol-1,
故答案为:SiCl4(s)+2H2(g)=Si(s)+4HCl(g)△H=+236 kJ•mol-1;
(2)碳酸钡与盐酸反应生成氯化钡、二氧化碳与水,反应离子方程式为:BaCO3+2H+=Ba2++CO2↑+H2O,
故答案为:BaCO3+2H+=Ba2++CO2↑+H2O;
(3)滤渣A的主要成分是Mg(OH)2、Ca(OH)2;温度越高,Ca(OH)2溶解度越小,控制温度70℃让钙离子沉淀完全,
故答案为:Mg(OH)2、Ca(OH)2;让钙离子沉淀完全;
(4)蒸发浓缩用到的含硅酸盐的仪器有:蒸发皿、酒精灯、玻璃棒,
故答案为:3.
点评 本题考查物质制备工艺流程,涉及物质的分离提纯、对操作与条件控制分析、热化学方程式书写等,关键是对工艺流程的理解,是对化学实验的综合考查,充分考查了学生的分析理解能力及知识迁移运用的能力,难度中等.

 阅读快车系列答案
阅读快车系列答案| R | ||
| X | T | Z |
| Q |
| A. | X的最高价氧化物能溶于强碱 | B. | 非金属性:T>R | ||
| C. | 单质导电性:Z>T>X | D. | R与Q的原子核外电子数相差16 |
| A. | 将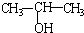 与NaOH的醇溶液共热制备CH3-CH=CH2 与NaOH的醇溶液共热制备CH3-CH=CH2 | |
| B. | 乙酰水杨酸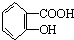 与适量NaOH溶液反应制备 与适量NaOH溶液反应制备 | |
| C. | 向CH3CH2Br中滴入AgNO3溶液以检验溴元素 | |
| D. | 苯酚在溴化铁催化作用下与液溴反应生成溴苯 |
| t/s | 0 | 5 | 15 | 25 | 35 |
| N(M)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
| A. | 35s时,N的浓度为0.80mol•L-1 | |
| B. | 达到平衡时,M的转化率为80% | |
| C. | 相同温度下若起始时向容器中充入1.0molP,则达到平衡时P的浓度为0.1mol•L-1 | |
| D. | 相同温度下,起始时向容器中充入0.20molM、0.20molN和1.0molP,反应达到平衡前v(逆)<v(正) |
| A. | 溶剂质量不变 | B. | 溶质质量变大 | C. | 溶液的浓度不变 | D. | 溶解度增大 |
| 选项 | 操作及现象 | 溶液 |
| A | 通入二氧化碳,溶液变浑浊 | 饱和碳酸钠溶液 |
| B | 通入二氧化碳,溶液变浑浊,继续通二氧化碳至过量,浑浊消失 | 硅酸钠溶液 |
| C | 通入二氧化碳,溶液变浑浊,继续通二氧化碳至过量,浑浊消失,再加入足量氢氧化钠溶液,又变浑浊 | 澄清石灰水 |
| D | 通入二氧化碳,溶液变浑浊,再加入品红溶液,红色褪色 | 次氯酸钙溶液 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 淀粉发酵 | B. | 乙烯加水 | C. | 乙醛还原 | D. | 乙酸乙酯水解 |