题目内容
2.氢气是一种新型的绿色能源,又是一种重要的化工原料.(1)氢气燃烧热值高.实验测得,在常温常压下1gH2完全燃烧生成液态水,放出142.9kJ热量.则表示H2燃烧热的热化学方程式为H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ/mol.又已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol,则氨气在空气中燃烧生成液态水和氮气时的热化学方程式为4NH3(g)+3O2(g)=2N2(g)+6H2O(l);△H=-1530kJ/mol.
(2)氢气是合成氨的重要原料.
①当合成氨反应达到平衡后,改变某一外界条件(不改变 N2、H2和NH3的量),反应速率与时间的关系如图1所示.
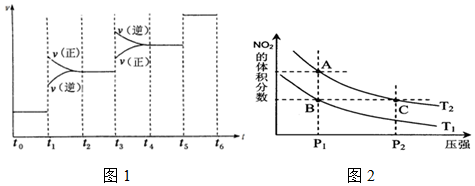
图中t1时引起平衡移动的条件可能是增大压强,其中表示平衡混合物中NH3的含量最高的一段时间是t2-t3.
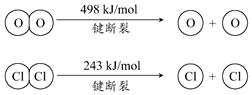
②氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如NO、NO2、N2O4等.对于反应:N2O4(g)?2NO2(g)△H>0,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图2所示.下列说法正确的是BDE.
A.A、C两点的化学平衡常数:A>C
B.A、C两点的气体颜色:A浅,C深
C.B、C两点的气体平均相对分子质量:B<C
D.A、C两点的反应速率:A<C
E.由状态B到状态A,可以用加热的方法.
分析 (1)1g氢气完全燃烧生成液态水时放出142.9kJ热量,2g氢气燃烧生成液态水放热285.8KJ,燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,结合热化学方程式书写;根据盖斯定律进行书写氨气在空气中燃烧生成液态水和氮气时的热化学方程式;
(2)①根据图象分析影响平衡的因素;
②A.A、C两点温度相等,则平衡常数相同;
B.增大压强平衡向逆反应进行,向逆反应进行是减小由于压强增大导致浓度增大趋势,但到达平衡仍比原平衡浓度大;
C.B、C两点相同物质的含量相同,即二氧化氮与四氧化二氮的物质的量之比相等;
D.A、C两点在等温线上,压强越大,反应速率越快;
E.压强相同,升高温度,化学平衡正向移动,NO2的体积分数增大.
解答 解:(1)1g氢气完全燃烧生成液态水时放出142.9kJ热量,2g氢气燃烧生成液态水放热285.8KJ,则氢气燃烧热的热化学方程式为:H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ/mol,
N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ/mol①
H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ/mol②
将方程式②×6-①×2得目标方程式,4NH3(g)+3O2(g)=2N2(g)+6H2O(l);△H=-1530kJ/mol,
故答案为:H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ/mol;4NH3(g)+3O2(g)=2N2(g)+6H2O(l)△H=-1530kJ/mol;
(2)①N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol,反应是放热反应,反应前后气体体积减小,依据反应速率与时间的关系图象分析,t1时正逆反应速率都增大,平衡正向移动,引起平衡移动的条件可能是增大压强;t1-t2平衡正向移动,t3-t4平衡逆向移动,t5-t6平衡不移动,所以表示平衡混合物中NH3的含量最高的一段时间是t2-t3,
故答案为:增大压强;t2-t3;
②A.A、C两点温度相等,则平衡常数相同,故A错误;
B.A、C两点都在等温线上,C的压强大,与A相比C点平衡向逆反应进行,向逆反应进行是由于减小体积增大压强,平衡移动的结果降低NO2浓度增大趋势,但到达平衡仍比原平衡浓度大,平衡时NO2浓度比A的浓度高,NO2为红棕色气体,则A、C两点气体的颜色:A浅,C深,故B正确;
C.B、C两点相同物质的含量相同,即二氧化氮与四氧化二氮的物质的量之比相等,则平均相对分子质量相等,故C错误;
D.由图象可知,A、C两点在等温线上,C的压强大,则A、C两点的反应速率:A<C,故D正确;
E.升高温度,化学平衡正向移动,NO2的体积分数增大,由图象可知,A点NO2的体积分数大,则T1<T2,由状态B到状态A,可以用加热的方法,故E正确.
故选BDE.
点评 本题考查燃烧热、化学平衡图象等,是对学生综合能力的考查,明确外界条件对化学平衡的影响及图象中纵横坐标的含义是解答本题的关键,注意燃烧热的概念应用,题目难度中等.

| A. | 电解饱和食盐水制得Cl2 | B. | 电解熔融MgCl2制得金属Mg | ||
| C. | 高温下CO还原赤铁矿可用于炼铁 | D. | 电解熔融AlCl3制得金属Al |
 用Cl2生产某些含氯有机物时会产生副产物HCl.利用如下反应,可实现氯的循环利用:
用Cl2生产某些含氯有机物时会产生副产物HCl.利用如下反应,可实现氯的循环利用:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)△H=-115.6 kJ•mol-1
下列说法正确的是( )
| A. | 升高温度能提高HCl的转化率 | |
| B. | 加入催化剂,能使该反运的焓变减小 | |
| C. | 1molCl2转化为2molCl原子放出243kJ热量 | |
| D. | 断裂H2O(g)中1mol H-O键比断裂HCl(g)中1mol H-Cl键所需能量高 |
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.186 | 0.143 | 0.089 | 0.104 | 0.074 |
| 主要化合价 | +1 | +3 | +2 | +6、-2 | -2 |
(2)B单质和C单质的化学性质相似,试写出C单质与强碱溶液反应的离子方程式Be+2OH-=BeO22-+H2↑;
(3)D和E组成的两种化合物中具有漂白性的是SO2,该化合物转化为另一种化合物的化学方程式为2SO2+O2$?_{△}^{催化剂}$2SO3 ;
(4)已知A的氢化物能与水反应生成一种可燃性气体和一种强碱,试写出该反应的化学方程式NaH+H2O=NaOH+H2↑.

| A. | 向CaC2O4饱和溶液中加入固体Na2C2O4可以由a点变到b点 | |
| B. | 通过蒸发可以由d点变到c点 | |
| C. | d点无CaC2O4沉淀生成 | |
| D. | a点对应的Ksp大于c点对应的Ksp |
 是一种由三种α-氨基酸分子脱水缩合生成的五肽的结构简式,这种五肽彻底水解时,不可能产生的氨基酸是( )
是一种由三种α-氨基酸分子脱水缩合生成的五肽的结构简式,这种五肽彻底水解时,不可能产生的氨基酸是( )



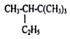 的系统命名为2,2,3,-三甲基戊烷;
的系统命名为2,2,3,-三甲基戊烷;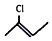 表示的分子式为C4H7Cl;
表示的分子式为C4H7Cl; .
. 研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义.
研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义.