题目内容
20.1.5mol Na2SO4•10H2O中所含的Na+的物质的量是3mol,所含的SO42-的物质的量是1.5mol,所含H2O的数目是9.03×1024或15NA.分析 Na2SO4•10H2O中,Na+的物质的量是Na2SO4•10H2O的物质的量的2倍,SO42-的物质的量等于Na2SO4•10H2O的物质的量,所含H2O分子的物质的量是Na2SO4•10H2O的物质的量的10倍.
解答 解:1.5mol Na2SO4•10H2O中所含的Na+的物质的量是1.5mol×2=3mol;所含的SO42-的物质的量是1.5mol×1=1.5mol,所含H2O的数目是1.5mol×10×6.02×1023mol-1=9.03×1024,
故答案为:3mol;1.5mol;9.03×1024或15NA.
点评 本题考查常用化学计量的有关计算,旨在考查学生对基础的理解掌握,比较基础,题目难度不大,注意微粒的组成.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
3.己知反应2H2(g)+02(g)=2H20(1)△H=-285.8kJ•mo1-1,下列正确的是( )
| A. | E(反应物)>E(生成物) | B. | E(反应物)<E(生成物) | C. | 反应放热 | D. | 反应吸热 |
11.下列各组物质相互混合反应,既有气体生成,最终又有沉淀生成的是( )
①金属钠投入到氯化铁溶液
②过量氢氧化钠溶液和明矾溶液
③碳酸氢钡溶液和硫酸氢钠溶液
④过氧化钠投入氯化铁溶液.
①金属钠投入到氯化铁溶液
②过量氢氧化钠溶液和明矾溶液
③碳酸氢钡溶液和硫酸氢钠溶液
④过氧化钠投入氯化铁溶液.
| A. | ①④ | B. | ②③④ | C. | ②③ | D. | ①③④ |
15.已知下列反应的反应热:
(1)CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H1=-870.3kJ•mol-1
(2)C(s)+O2(g)═CO2(g)△H2=-393.5kJ•mol-1
(3)H2(g)+O2(g)═H2O(l)△H3=-285.8kJ•mol-1
则下列反应的反应热为( )
2C(s)+2H2(g)+O2(g)═CH3COOH(l)
(1)CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H1=-870.3kJ•mol-1
(2)C(s)+O2(g)═CO2(g)△H2=-393.5kJ•mol-1
(3)H2(g)+O2(g)═H2O(l)△H3=-285.8kJ•mol-1
则下列反应的反应热为( )
2C(s)+2H2(g)+O2(g)═CH3COOH(l)
| A. | △H=+488.3 kJ•mol-1 | B. | △H=-244.15 kJ•mol-1 | ||
| C. | △H=-977.6 kJ•mol-1 | D. | △H=-488.3 kJ•mol-1 |
5.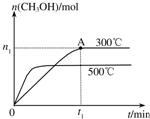 在容积为2L的密闭容器中进行反应:CO(g)+2H2(g)?CH3OH(g),其他条件不变,在300℃和500℃时,物质的量n(CH3OH)-反应时间t的变化曲线如图所示,下列说法正确的是( )
在容积为2L的密闭容器中进行反应:CO(g)+2H2(g)?CH3OH(g),其他条件不变,在300℃和500℃时,物质的量n(CH3OH)-反应时间t的变化曲线如图所示,下列说法正确的是( )
 在容积为2L的密闭容器中进行反应:CO(g)+2H2(g)?CH3OH(g),其他条件不变,在300℃和500℃时,物质的量n(CH3OH)-反应时间t的变化曲线如图所示,下列说法正确的是( )
在容积为2L的密闭容器中进行反应:CO(g)+2H2(g)?CH3OH(g),其他条件不变,在300℃和500℃时,物质的量n(CH3OH)-反应时间t的变化曲线如图所示,下列说法正确的是( )| A. | 该反应的△H<0 | |
| B. | 其他条件不变,升高温度反应的平衡常数增大 | |
| C. | 300℃时,0-t1min内 CH3OH的平均生成速率为$\frac{{n}_{1}}{2{t}_{1}}$mol•L-1 min-1 | |
| D. | A点的反应体系从300℃升高到500℃,达到平衡时$\frac{n({H}_{2})}{n(C{H}_{3}OH)}$减小 |
12.下列操作中,溶液的颜色不发生变化的是( )
| A. | 碳酸氢钠溶液中滴加稀盐酸 | B. | 硫酸铁溶液中滴加硫氰化钾溶液 | ||
| C. | 碘水中滴加淀粉碘化钾溶液 | D. | 氯化铁溶液中加入还原性铁粉 |
9.有羟基生成的反应的反应类型可能为( )
①取代反应 ②加成反应 ③消去反应 ④水解反应 ⑤还原反应 ⑥酯化反应 ⑦硝化反应.
①取代反应 ②加成反应 ③消去反应 ④水解反应 ⑤还原反应 ⑥酯化反应 ⑦硝化反应.
| A. | ①②④⑤ | B. | ①②⑥⑦ | C. | ③⑤⑦ | D. | ②③⑤⑥ |