题目内容
有如图装置,下列有关该装置反应开始时的叙述正确的是( )


| A、锌极附近滴入酚酞,溶液呈红色 |
| B、铁极发生的电极反应为:2H2O+O2+4e═4OH- |
| C、铁极发生吸氧腐蚀生成锈蚀 |
| D、溶液中的OH-离子向铁极移动 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:该装置属于原电池,较活泼的金属Zn作负极,Fe作正极,负极上Zn失电子生成锌离子,正极上氧气得电子和水反应生成氢氧根离子,溶液中阴离子向负极移动.
解答:
解:A.Fe作正极,正极上氧气得电子和水反应生成氢氧根离子,溶液呈红色,故A错误;
B、Fe作正极,正极上氧气得电子和水反应生成氢氧根离子,其电极反应为:2H2O+O2+4e═4OH-,故B正确;
C、Fe作正极,正极上氧气得电子和水反应生成氢氧根离子,Fe不参与反应,故C错误;
D.溶液中阴离子向负极移动,即的OH-离子向Zn极移动,故D错误.
故选B.
B、Fe作正极,正极上氧气得电子和水反应生成氢氧根离子,其电极反应为:2H2O+O2+4e═4OH-,故B正确;
C、Fe作正极,正极上氧气得电子和水反应生成氢氧根离子,Fe不参与反应,故C错误;
D.溶液中阴离子向负极移动,即的OH-离子向Zn极移动,故D错误.
故选B.
点评:本题以金属的腐蚀为载体考查了原电池原理,明确中性或碱性条件下发生吸氧腐蚀,题目难度不大.

练习册系列答案
 全能测控一本好卷系列答案
全能测控一本好卷系列答案
相关题目
下列在水溶液中能大量共存的一组是( )
| A、NH4+、Na+、Br-、SO42- |
| B、Fe2+、Al3+、ClO-、Cl- |
| C、Al3+、[A1(OH)4]-、Na+、Cl- |
| D、Mg2+、H+、SiO32-、SO42- |
将CoCl2溶解于盐酸中可以形成[CoCl4]2-,在溶液中存在下面的化学平衡,Co2+(aq)(粉红色)+4Cl-(aq)?CoCl42-(aq)(蓝色)△H>0,下列说法正确的是( )
| A、该反应的平衡常数K=c ([CoCl4]2-)2/[c (Co2+)?c (Cl-)4] |
| B、升高温度,正反应速率增大,逆反应速率减小 |
| C、将盛有CoCl2和盐酸混合液的试管置于热水中,试管内溶液为蓝色 |
| D、增大Cl-浓度,平衡向正反应方向移动,Co2+、Cl-浓度都减小 |
已知农药波尔多液不能用铁制容器盛放,是因为铁能与农药中的硫酸铜起反应,则下列反应原理和上述原理相同的是( )
| A、氢氧化钠溶液不能用带玻璃塞子的试剂瓶保存 |
| B、澄清石灰水在空气中变质 |
| C、实验室用锌和稀硫酸制氢气 |
| D、氯化钠在水溶液中电离 |
在下列反应中,HCl做还原剂的是( )
| A、Zn+2HCl=H2↑+ZnCl2 | ||||
| B、CaCO3+2HCl=CO2↑+CaCl2+H2O | ||||
C、MnO2+4HCl(浓)
| ||||
| D、HCl+KOH=KCl+H2O |
下列溶液中,物质的量浓度最大的是( )
| A、1LH2SO4溶液中含98gH2SO4 |
| B、0.5 L含49gH2SO4的溶液 |
| C、98gH2SO4溶于水配成2 L溶液 |
| D、0.1 L含24.5gH2SO4的溶液 |
正丙醇蒸气与空气混合通过热铜网,生成一种化合物,与该化合物互为同分异构体的是( )
| A、CH3CH2OCH3 |
B、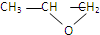 |
C、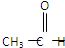 |
| D、CH3COOCH3 |
“人文奥运、科技奥运、绿色奥运”是2008年北京奥运会的重要特征.其中禁止运动员使用兴奋剂是重要举措之一.以下两种兴奋剂的结构分别为( )

则关于它们的说法中正确的是( )

则关于它们的说法中正确的是( )
| A、1 mol兴奋剂X与足量浓溴水反应,最多消耗5 mol Br2 |
| B、1 mol兴奋剂Y与足量NaOH溶液反应,最多消耗3 mol NaOH |
| C、两种兴奋剂遇FeCl3溶液均显色,均属于苯酚的同系物 |
| D、兴奋剂X所有碳原子有可能共平面 |
C5H12O的同分异构体中可以氧化为醛的醇有( )
| A、1种 | B、2种 | C、3种 | D、4种 |