题目内容
下列在水溶液中能大量共存的一组是( )
| A、NH4+、Na+、Br-、SO42- |
| B、Fe2+、Al3+、ClO-、Cl- |
| C、Al3+、[A1(OH)4]-、Na+、Cl- |
| D、Mg2+、H+、SiO32-、SO42- |
考点:离子共存问题
专题:离子反应专题
分析:A.NH4+、Na+、Br-、SO42-离子之间不满足离子反应发生条件;
B.次氯酸根离子具有强氧化性,能够氧化亚铁离子;
C.铝离子和偏铝酸根离子能够发生双水解反应生成氢氧化铝沉淀;
D.氢离子能够与硅酸根离子反应生成硅酸.
B.次氯酸根离子具有强氧化性,能够氧化亚铁离子;
C.铝离子和偏铝酸根离子能够发生双水解反应生成氢氧化铝沉淀;
D.氢离子能够与硅酸根离子反应生成硅酸.
解答:
解:A.NH4+、Na+、Br-、SO42-之间不发生反应,在溶液中能够大量共存,故A正确;
B.ClO-能够氧化Fe2+,在溶液中不能大量共存,故B错误;
C.Al3+、[A1(OH)4]-之间能够发生反应生成氢氧化铝沉淀,在溶液中不能大量共存,故C错误;
D.H+、SiO32-之间能够反应生成硅酸沉淀,在溶液中不能大量共存,故D错误;故选A.
B.ClO-能够氧化Fe2+,在溶液中不能大量共存,故B错误;
C.Al3+、[A1(OH)4]-之间能够发生反应生成氢氧化铝沉淀,在溶液中不能大量共存,故C错误;
D.H+、SiO32-之间能够反应生成硅酸沉淀,在溶液中不能大量共存,故D错误;故选A.
点评:本题考查离子共存的正误判断,该题是高考中的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能生成难溶物的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;试题侧重对学生基础知识的训练和检验,有利于培养学生的逻辑推理能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
欲增大铁与酸反应放出氢气的速率,下列措施中不正确的是( )
| A、用铁粉代替铁片 |
| B、提高反应温度 |
| C、用浓硫酸代替稀硫酸 |
| D、去除铁表面的铁锈 |
下列关于药物的使用说法正确的是( )
| A、能用于治疗胃酸过多的抗酸药通常含有麻黄碱 |
| B、青霉素有解热镇痛的作用 |
| C、阿司匹林是最重要的抗生素 |
| D、碘酒能使蛋白质变性,是一种外用消毒药 |
某中药的有效成分M具有清炎杀菌作用,M的结构如图所示 :已知
:已知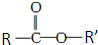 和NaOH反应能生成RCOONa和R′OH,下列叙述正确的是( )
和NaOH反应能生成RCOONa和R′OH,下列叙述正确的是( )
 :已知
:已知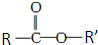 和NaOH反应能生成RCOONa和R′OH,下列叙述正确的是( )
和NaOH反应能生成RCOONa和R′OH,下列叙述正确的是( )| A、M的相对分子质量是180 |
| B、1mol M最多能与2mol Br2发生反应 |
| C、M与足量的Na溶液发生反应时,所得有机产物的化学式为C9H4O4Na2 |
| D、1mol M与足量NaHCO3反应能生成2mol CO2 |
在恒温下容积固定的密闭容器中,能充分说明反应 2NO+O2?2NO2 已达到平衡状态的是( )
| A、反应容器中的气体压强不随时间而变化 |
| B、生成O2的速率与生成NO2的速率相等 |
| C、NO、O2、NO2各浓度之比为2:1:2 |
| D、混合气体的密度一定 |
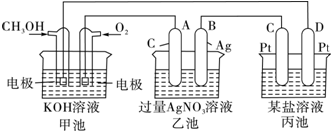
有如图装置,下列有关该装置反应开始时的叙述正确的是( )


| A、锌极附近滴入酚酞,溶液呈红色 |
| B、铁极发生的电极反应为:2H2O+O2+4e═4OH- |
| C、铁极发生吸氧腐蚀生成锈蚀 |
| D、溶液中的OH-离子向铁极移动 |
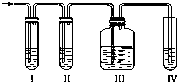 实验室制取乙烯,常因温度过高而使乙醇和浓H2SO4反应生成少量的二氧化硫,有人设计下列实验以确认上述混合气体中有乙烯和二氧化硫.
实验室制取乙烯,常因温度过高而使乙醇和浓H2SO4反应生成少量的二氧化硫,有人设计下列实验以确认上述混合气体中有乙烯和二氧化硫.