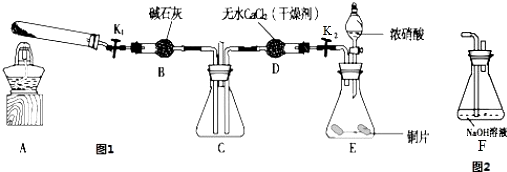
��Ŀ����
19��ijʵ����Ϊ�о�����ͬ�������Ի�ѧƽ���Ӱ�����������������ʵ�飺һ�������£���һ���ܱ������м���0.30molX��0.10molY��һ������Z�������壬��ͼ��ʾ������Ӧ�������Ũ�ȣ�c����ʱ�䣨t���ı仯������t0��t1��c��Z��δ����������ͼ��ʾ��ѧ��Ӧ���ʣ�v����ʱ�䣨t���ı仯���ĸ��ζ�ֻ�ı�һ���������������¶ȡ�Ũ�ȡ�ѹǿ��ÿ�θı���������ͬ������֪t3��t4��Ϊʹ�ô�����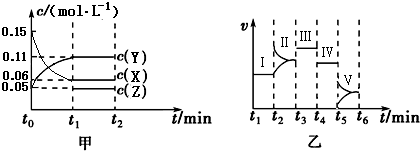
�ش��������⣺
��1����t1=5min����t0��t1����XŨ�ȱ仯��ʾ�ķ�Ӧ����Ϊv��X��=0.018mol•L-1•min-1��
��2����t2��t3��Y�����ʵ�����С����˽ο�ʼʱv����v�������������=����������
��3��t4��t5�θı������Ϊ��Сѹǿ���˽ε�ƽ�ⳣ��K=2.8��
��4��t5��t6��������Z�����ʵ���������0.10mol���ڷ�Ӧ�������仯����Ϊa kJ��д���÷�Ӧ���Ȼ�ѧ����ʽ3X��g��
 2Y��g��+Z��g����H=-10akJ/mol������ͼ����ƽ���У�ƽ�ⳣ�������Ǣ���
2Y��g��+Z��g����H=-10akJ/mol������ͼ����ƽ���У�ƽ�ⳣ�������Ǣ�����5������ʼʵ���������䣬������������м���0.60mol X��0.20mol Y��0.080mol Z����Ӧ��ƽ��״̬��X��ת����=60%��
���� ��1����ͼ�����X��Ũ�ȱ仯�����ݷ�Ӧ����v��X��=$\frac{��c��X��}{��t}$���㣻
��2��t4��t5�����淴Ӧ���ʼ�С����ȣ�����ǽ����¶ȣ�ƽ���ƶ������ƶ��������淴Ӧ���ʲ���ȣ�����Y��XŨ�ȵı仯�ж϶���������ϵ������t4��t5���жϻ�ѧ����ʽ����ͼ�ҿ�֪t2ʱ������ijһ���ʵ�Ũ�ȣ���֪t2-t3�Σ�Y�����������С����������Z��Ũ�ȣ�����ƽ���ƶ����ж����淴Ӧ���ʵĹ�ϵ��
��3���ɣ�2��������֪t4��t5�θı������Ϊ��Сѹǿ����ʱƽ�ⳣ�����䣻
��4����������1molZ��Ӧ�������仯����Ϸ���ʽ��д�Ȼ�ѧ����ʽ������ʱƽ�������ƶ���ƽ�ⳣ������
��5������ƽ�ⳣ������������´ﵽƽ��ʱ����ֵ�Ũ�ȣ�����X�ļ�С�������ɼ���X��ת���ʣ�
��� �⣺��1��ͼ����t0��t1��XŨ�ȱ仯Ϊ0.15mol/L-0.06mol/L=0.09mol/L��XŨ�ȱ仯��ʾ�ķ�Ӧ����Ϊv��X��=$\frac{��c��X��}{��t}$=$\frac{0.09mol/L}{5min}$=0.018 mol•L-1•min-1��
�ʴ�Ϊ��0.018 mol•L-1•min-1��
��2��t3��t4����t4��t5�����淴Ӧ���ʶ���ȣ���t3��t4��Ϊʹ�ô��������t4��t5�θı������Ϊ���ͷ�Ӧ�¶ȣ�ƽ���ƶ������ƶ��������淴Ӧ���ʲ���ȣ���t4��t5��ӦΪ��Сѹǿ����Ӧ��X��Ũ�ȱ仯Ϊ0.15mol/L-0.06mol/L=0.09mol/L��Y��Ũ�ȱ仯Ϊ0.11mol/L-0.05mol/L=0.06mol/L����Ӧ��X��Y�ļ�����֮��Ϊ0.09��0.06=3��2����÷�Ӧ������Ļ�ѧ������֮��ǰ����ȣ����У�3X��g��?Z��g��+2Y��g����
��ͼ�ҿ�֪t2ʱ������ijһ���ʵ�Ũ�ȣ���֪t2-t3�Σ�Y�����������С����������Z��Ũ�ȣ�����Z��Ũ��ƽ�����淽���ƶ�������v��С��v�棻
�ʴ�Ϊ������
��3���ɣ�2������֪t4��t5�θı������Ϊ��Сѹǿ��t2��t3��Ϊ�������Ũ�ȣ�t5��t6�����淴Ӧ���ʾ���ͻ�䣬Ϊ�ı��¶ȣ�����t4��t5�ε�ƽ�ⳣ������t2��t3�ε�ƽ�ⳣ��K=$\frac{c��Z��•c��Y��^{2}}{c��X��^{3}}$=$\frac{0.05mol/L����0.11mol/L��^{2}}{��0.06mol/L��^{3}}$=2.8��
�ʴ�Ϊ����Сѹǿ��2.8��
��4��t5��t6��������Z�����ʵ���������0.10mol���ڷ�Ӧ�������仯����Ϊa kJ��������1molZ�������仯Ϊ10a kJ�����ڽ���Z�������ӣ�����ӦΪ���ȷ�Ӧ��
���Ը÷�Ӧ���Ȼ�ѧ����ʽ3X��g�� 2Y��g��+Z��g����H=-10a kJ/mol������ʱƽ�������ƶ���ƽ�ⳣ���������Ԣ�ʱƽ�ⳣ�����
2Y��g��+Z��g����H=-10a kJ/mol������ʱƽ�������ƶ���ƽ�ⳣ���������Ԣ�ʱƽ�ⳣ�����
�ʴ�Ϊ��3X��g�� 2Y��g��+Z��g����H=-10a kJ/mol������
2Y��g��+Z��g����H=-10a kJ/mol������
��5��3X��g�� 2Y��g��+Z��g��
2Y��g��+Z��g��
��ʼ����mol��0.6 0.2 0.08
�仯����mol��3a 2a a
ƽ������mol��0.6-3a 0.2+2a 0.08+a
��ƽ�ⳣ��K=$\frac{��\frac{0.2+2a}{V}��^{2}����\frac{0.08+a}{V}��}{��\frac{0.6-3a}{V}��^{3}}$=2.8��a=0.12����Ӧ��ƽ��״̬��X��ת����=$\frac{3��0.12mol}{0.6mol}��100%$=60%��
�ʴ�Ϊ��60%��
���� ���⿼�黯ѧƽ���ƶ�ͼ���⣬��Ŀ�ѶȽϴ�ע�����ͼ�жϸ��ε�Ӱ�����أ���Ϊ������Ĺؼ����״���Ϊ����Ӱ�����أ�

| A�� | �ζ�ǰ��Ҫ���ζ����Ƿ�©ˮ | |
| B�� | �ö�Ӧ�������Һ��ϴ�������У���ʽ�ζ��ܡ���ƿ | |
| C�� | �ζ��ܣ�װ����Һ���ڵζ�ǰ���촦�����ݣ��ζ����������ݣ���ʹ�ζ����ƫ�� | |
| D�� | ����֪Ũ������ζ�δ֪Ũ�ȵ�NaOH��Һ���յ����ʱ���ӵζ��ܵĿ̶ȣ�����ɼ���ֵƫ�� |
 ��
�� ��
�� ��
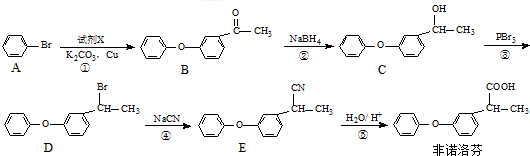
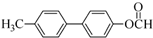
��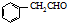 Ϊԭ���Ʊ�
Ϊԭ���Ʊ� �ĺϳ�·������ͼ�����Լ����ã����ϳ�·������ͼʾ�����£�H2C=CH2$��_{����}^{H_{2}O}$CH3CH2OH$��_{Ũ�����}^{CH_{3}COOH}$CH3COOC2H5��
�ĺϳ�·������ͼ�����Լ����ã����ϳ�·������ͼʾ�����£�H2C=CH2$��_{����}^{H_{2}O}$CH3CH2OH$��_{Ũ�����}^{CH_{3}COOH}$CH3COOC2H5�� ��
��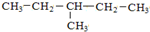
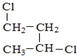 ��
�� ��H2O��D2O
��H2O��D2O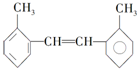 �䱽���ϵ�һ�ȴ�����4�֣�1mol�����ʺ���ˮ��ϣ�����Br2�����ʵ���Ϊ1mol��
�䱽���ϵ�һ�ȴ�����4�֣�1mol�����ʺ���ˮ��ϣ�����Br2�����ʵ���Ϊ1mol��