题目内容
16.将一定体积的CO2通入VL NaOH溶液中,已知NaOH完全反应.在反应的溶液中加入足量石灰水,得到mg沉淀.(1)能否用上述数据确定参加反应的CO2的体积(标准状况)?能(“能”或“不能”),
(2)若在上述CO2和NaOH反应后的溶液不加入石灰水而是加入足量CaCl2溶液,结果得到了沉淀n g.设原NaOH溶液的物质的量浓度为c,则:①当n=m时,c=$\frac{2m}{100V}$mol/L;②当n=0时,c=$\frac{m}{100V}$mol/L;③当n<m时,c=$\frac{m+n}{100V}$mol/L.
分析 (1)二氧化碳与氢氧化钠反应时,无论生成碳酸钠,还是碳酸氢钠,或二者都有,再加入足量的石灰水都会生成碳酸钙,根据碳元素守恒可以计算二氧化碳体积;
(2)若反应后的溶液中,加入足量CaCl2溶液,发生反应:Na2CO3+CaCl2═CaCO3↓+2NaCl,NaHCO3与CaCl2不反应.
①当n=m时,说明CO2与NaOH溶液反应的产物只有Na2CO3,由碳原子守恒n(Na2CO3)=n(CaCO3),根据钠离子守恒n(NaOH)=2n(Na2CO3);
②当n=0时,说明CO2与NaOH溶液反应的产物只有NaHCO3,由碳原子守恒n(NaHCO3)=n(CaCO3),根据钠离子守恒n(NaOH)=n(NaHCO3);
③当n<m时,说明CO2与NaOH溶液反应的产物为Na2CO3、NaHCO3,根据碳原子守恒计算Na2CO3、NaHCO3的物质的量,再根据钠离子守恒计算n(NaOH),进而计算氢氧化钠溶液浓度.
解答 解:(1)二氧化碳与氢氧化钠反应时,无论生成碳酸钠,还是碳酸氢钠,或二者都有,再加入足量的石灰水都会生成碳酸钙,根据碳元素守恒可以计算二氧化碳物质的量,可以计算标况下二氧化碳的体积,
故答案为:能;
(2)若反应后的溶液中,加入足量CaCl2溶液,发生反应:Na2CO3+CaCl2═CaCO3↓+2NaCl,NaHCO3与CaCl2不反应.
①当n=m时,说明CO2与NaOH溶液反应的产物只有Na2CO3,由碳原子守恒n(Na2CO3)=n(CaCO3)$\frac{mg}{100g/mol}$=0.01m mol,根据钠离子守恒n(NaOH)=2n(Na2CO3)=0.02m mol,故NaOH溶液浓度为$\frac{0.02mmol}{VL}$=$\frac{2m}{100V}$mol/L;
②当n=0时,说明CO2与NaOH溶液反应的产物只有NaHCO3,由碳原子守恒n(NaHCO3)=n(CaCO3)=$\frac{mg}{100g/mol}$=0.01m mol,根据钠离子守恒n(NaOH)=n(NaHCO3)=0.01mol,故NaOH溶液浓度为$\frac{0.01mmol}{VL}$$\frac{m}{100V}$mol/L;
③当n<m时,说明CO2与NaOH溶液反应的产物为Na2CO3、NaHCO3,与氯化钙反应反应时,根据碳原子守恒n(Na2CO3)=n(CaCO3)=$\frac{ng}{100g/mol}$=0.01n mol,与氢氧化钙溶液反应时,根据碳原子守恒n(Na2CO3)+n(NaHCO3)=n(CaCO3)=0.01m mol,故n(NaHCO3)=(0.01m-0.01n)mol,根据钠离子守恒n(NaOH)=2×0.01n mol+(0.01m-0.01n)mol=(0.01m+0.01n)mol,故氢氧化钠溶液浓度为$\frac{(0.01m+0.01n)mol}{VL}$=$\frac{m+n}{100V}$mol/L,
故答案为:$\frac{2m}{100V}$mol/L;$\frac{m}{100V}$mol/L;$\frac{m+n}{100V}$mol/L.
点评 本题考查化学方程式计算、混合物计算,关键根据最终沉淀质量关系判断CO2与NaOH溶液反应的产物.

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案| A. | 0.15 | B. | 0.20 | C. | 0.25 | D. | 0.30 |
| A. | 氯化钾溶液在电流作用下电离成K+和Cl- | |
| B. | 氧化还原反应的本质是有化合价的升降 | |
| C. | 依据丁达尔效应可将分散系分为溶液、胶体与浊液 | |
| D. | 碱性氧化物均属于金属氧化物 |
| A. | H2SO4═2H++SO42- | B. | NH4NO3═NH4++NO3- | ||
| C. | Na2CO3═Na2++CO32- | D. | Ba(OH)2═Ba2++2OH- |
| A. | 大理石和硝酸:CO32-+2H+═H2O+CO2↑ | |
| B. | 铁和稀盐酸:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 稀硫酸和氨水:H++NH3•H2O═NH4++H2O | |
| D. | 碳酸氢钙溶液和盐酸:HCO3-+H+═H2O+CO2↑ |
| A. | Fe可以和S在加热条件下生成Fe2S3 | |
| B. | Cl2和H2S相遇可发生反应:H2S+Cl2═2HCl+S↓ | |
| C. | 在酸性溶液中,Fe3+和S2-可以大量共存 | |
| D. | Cl2可以氧化Fe3+ |
| A. | NaCl 溶液 | B. | NaBr 溶液 | C. | NaI 溶液 | D. | Na2S 溶液 |
 W、X、Y、Z四种短周期元素在周期表中的位置如图1所示,其中Y与钠元素和氢元素均可形成原子个数1:1和1:2的化合物.
W、X、Y、Z四种短周期元素在周期表中的位置如图1所示,其中Y与钠元素和氢元素均可形成原子个数1:1和1:2的化合物.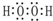 ,Z在周期表中的位置第三周期ⅦA族.
,Z在周期表中的位置第三周期ⅦA族.