题目内容
17.关于图中装置说法正确的是( )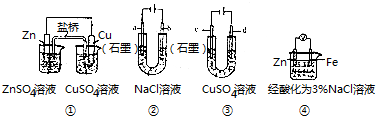
| A. | 装置①中,盐桥(含有琼胶的KCl饱和溶液)中的K+移向ZnSO4溶液 | |
| B. | 装置②工作一段时间后,a极附近溶液的pH减小 | |
| C. | 用装置③精炼铜时,c极为纯铜 | |
| D. | 装置④中电子由Zn流向Fe,装置中有Fe2+生成 |
分析 A、原电池中阳离子向正极移动,铜是正极;
B、装置②工作一段时间后,a极与电源的负极相连是阴极,电极反应式为:水中的氢离子放电,产生氢氧根离子;
C、精炼铜时,纯铜为阴极;
D、活泼金属锌是负极,所以产生锌离子.
解答 解:A、原电池中阳离子向正极移动,铜是正极,所以K+移向CuSO4溶液,故A错误;
B、装置②工作一段时间后,a极与电源的负极相连是阴极,电极反应式为:水中的氢离子放电,产生氢氧根离子,所以溶液的PH值增大,故B错误;
C、精炼铜时,纯铜为阴极,所以c为阴极,c极为纯铜,故C正确;
D、活泼金属锌是负极,所以产生锌离子,而不是亚铁离子,故D错误;
故选C.
点评 本题考查电化学的相关知识,涉及离子的移动方向、电极的反应后PH的变化和电镀等,综合性强,但比较容易.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
8.利用下列装置(部分仪器已省略),能顺利完成对应实验的是( )
| A. |  实验室制取乙烯 | B. | 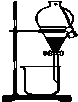 利用酒精萃取碘水中的I2单质 | ||
| C. | 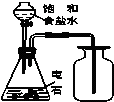 实验室制取乙炔并收集 | D. | 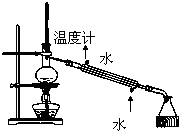 石油的分馏实验 |
5.已知反应A(g)+3B(g)?2C(g)+D(s),1molA和3molB在2L密闭容器中进行上述反应,若2min后,测得C的浓度为0.2mol/L,则下列说法正确的是( )
| A. | v(D)=0.05mol/(L•min) | B. | 3v(B)=2v(C) | ||
| C. | v(B)=0.15mol/(L•min) | D. | A的转化率为40% |
12.电解100mlpH=1的下列溶液,当电路中通过0.02mol电子时,理论上析出金属质量最大的是( )
| A. | 0.10mol•L-1Ag+ | B. | 0.20mol•L-1Zn2+ | C. | 0.20mol•L-1Cu2+ | D. | 0.20mol•L-1Pb2+ |
2.(1)CO2和CH4是两种重要的温室气体,通过CH4和CO2的反应,制造更高价值的化学品是目前的研究目标.250℃时,以镍合金为催化剂,发生如下反应:CO2(g)+CH4(g)?2CO(g)+2H2(g)
①此温度下该反应的平衡常数表达式K=$\frac{c(CO)^{2}×c({H}_{2})^{2}}{c(C{O}_{2})×c(C{H}_{4})}$.
②已知:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ•mol-1
CO(g)+H2O(g)═CO2(g)+H2(g)△H=+2.8kJ•mol-1
2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ•mol-1
反应CO2(g)+CH4(g)?2CO(g)+2H2(g)的△H=+247.3kJ•mol-1kJ•mol-1;
(2)能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.工业上合成甲醇的反应原理为:CO(g)+2H2(g)?CH3OH(g)△H,
下表所列数据是该反应在不同温度下的化学平衡常数(K).
①根据表中数据可判断△H<0 (填“>”、“=”或“<”).
②300℃时,将2molCO、3molH2和2molCH3OH充入容积为1L的密闭容器中,此时反应将A.
A.向正方向移动 B.向逆方向移动 C.处于平衡状态 D.无法判断
③下列能说明上述反应达到化学平衡状态的标志是C
A.恒温恒容下,混合气体的密度不在变化
B.达平衡时,v(CO):v(H2):v(CH3OH)=1:2:1
C.达平衡时,CH3OH浓度不再变化
D.单位时间内生产nmolCO同时生成2nmolH2.
①此温度下该反应的平衡常数表达式K=$\frac{c(CO)^{2}×c({H}_{2})^{2}}{c(C{O}_{2})×c(C{H}_{4})}$.
②已知:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ•mol-1
CO(g)+H2O(g)═CO2(g)+H2(g)△H=+2.8kJ•mol-1
2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ•mol-1
反应CO2(g)+CH4(g)?2CO(g)+2H2(g)的△H=+247.3kJ•mol-1kJ•mol-1;
(2)能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.工业上合成甲醇的反应原理为:CO(g)+2H2(g)?CH3OH(g)△H,
下表所列数据是该反应在不同温度下的化学平衡常数(K).
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
②300℃时,将2molCO、3molH2和2molCH3OH充入容积为1L的密闭容器中,此时反应将A.
A.向正方向移动 B.向逆方向移动 C.处于平衡状态 D.无法判断
③下列能说明上述反应达到化学平衡状态的标志是C
A.恒温恒容下,混合气体的密度不在变化
B.达平衡时,v(CO):v(H2):v(CH3OH)=1:2:1
C.达平衡时,CH3OH浓度不再变化
D.单位时间内生产nmolCO同时生成2nmolH2.
9.CO是甲酸(HCOOH)的酸酐,将甲酸与下列某物质混合可制取CO,该物质是( )
| A. | 浓硫酸 | B. | 碳粉 | C. | NaOH固体 | D. | Na2O2粉末 |
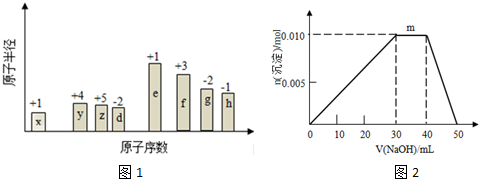
 ,(yz)2称为拟卤素,性质与卤素类似,其与氢氧化钠溶液反应的化学方程式是2NaOH+(CN)2=NaCN+NaCNO+H2O.
,(yz)2称为拟卤素,性质与卤素类似,其与氢氧化钠溶液反应的化学方程式是2NaOH+(CN)2=NaCN+NaCNO+H2O. .
.