题目内容
12.电解100mlpH=1的下列溶液,当电路中通过0.02mol电子时,理论上析出金属质量最大的是( )| A. | 0.10mol•L-1Ag+ | B. | 0.20mol•L-1Zn2+ | C. | 0.20mol•L-1Cu2+ | D. | 0.20mol•L-1Pb2+ |
分析 在电解池中,阴极上阳离子的放电顺序是:银离子>铜离子>氢离子,只有放电顺序在H+前的才析出金属,根据电极反应结合电子守恒来计算即可.
解答 解:Zn2+和Pb2+的放电顺序都在H+后面,所以含有这两种阳离子的盐溶液中,阴极上放出H2,而含有银离子和铜离子这两种阳离子的盐溶液中,Ag和Cu金属先在阴极析出.
A.0.10mol∕LAg+在氢离子之前放电,金属银的质量是 0.1mol/L×0.1L×108g/mol=1.08g;
B.Zn2+的放电顺序在H+后面,所以含有这种阳离子的盐溶液中,阴极上放出H2,不会析出金属;
C.铜离子先放电,100mL0.20mol∕LCu2+完全放电时得到0.04mol电子,所以析出金属铜的质量为$\frac{1}{2}$×0.02mol×64g/mol=0.64g;
D.Pb2+的放电顺序在H+后面,所以含有这种阳离子的盐溶液中,阴极上放出H2,不会析出金属.
所以析出金属质量最大的是0.10mol•L-1Ag+.
故选A.
点评 本题考查电解原理,为高频考点,把握离子的放电顺序、电极反应是解本题关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.常温下,下列叙述正确的是( )
| A. | pH<7的溶液是酸的溶液 | |
| B. | pH>7的溶液是碱的溶液 | |
| C. | pH>7的溶液有可能是盐的溶液,这是因为盐可能电离出H+ | |
| D. | pH>7的溶液有可能是盐的溶液,这是盐类水解造成的 |
20. 维生素C又名抗坏血酸,具有酸性和强还原性,也是一种常见的食品添加剂,其结构如图.下列有关说法中正确的是( )
维生素C又名抗坏血酸,具有酸性和强还原性,也是一种常见的食品添加剂,其结构如图.下列有关说法中正确的是( )
 维生素C又名抗坏血酸,具有酸性和强还原性,也是一种常见的食品添加剂,其结构如图.下列有关说法中正确的是( )
维生素C又名抗坏血酸,具有酸性和强还原性,也是一种常见的食品添加剂,其结构如图.下列有关说法中正确的是( )| A. | 维生素C与足量金属钠反应产生氢气是维生素C物质的量的4倍 | |
| B. | 维生素C因为含有酯基而难溶于水 | |
| C. | 维生素C中含有醚键 | |
| D. | 维生素C的酸性可能是③、④两个羟基引起的 |
7.下列有关叙述正确的是( )
| A. | 不需要加热就能发生的反应一定是放热反应 | |
| B. | HF、Ca(OH)2、BaSO4都是强电解质 | |
| C. | Na2O2溶于水,生成NaOH,其水溶液能导电,故Na2O2不是电解质 | |
| D. | 升高温度,可同时提高活化分子百分数和活化分子浓度,使化学反应速率加快 |
17.关于图中装置说法正确的是( )
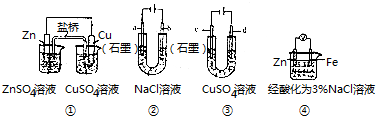

| A. | 装置①中,盐桥(含有琼胶的KCl饱和溶液)中的K+移向ZnSO4溶液 | |
| B. | 装置②工作一段时间后,a极附近溶液的pH减小 | |
| C. | 用装置③精炼铜时,c极为纯铜 | |
| D. | 装置④中电子由Zn流向Fe,装置中有Fe2+生成 |
1.下列陈述Ⅰ、Ⅱ正确且有因果关系的是( )
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | Cl2有漂白作用 | Cl2能使湿润的有色布条褪色 |
| B | SiO2有导电性 | SiO2可用于制备光导纤维 |
| C | 浓硫酸有强氧化性 | 浓硫酸可用于干燥H2和CO |
| D | 浓氨汽化时要吸收大量的热 | 浓氨可用作制冷剂 |
| A. | A | B. | B | C. | C | D. | D |
2.科研、生产和生活中的下列做法,利用了氧化还原反应的是( )
| A. | 用乙醚从黄花蒿中提取青蒿素 | B. | 用氯化铁溶液腐蚀铜制印刷电路板 | ||
| C. | 空气净化器中用活性炭层净化空气 | D. | 用热的纯碱溶液去除油污 |