题目内容
短周期主族元素A、B形成AB3型分子,下列有关叙述正确的是( )
| A、若A、B为同一周期元素,则AB3分子一定为平面正三角形 |
| B、若AB3分子中的价电子个数为24个,则AB3分子为平面正三角形 |
| C、若为A、B为同一主族元素,则AB3分子一定为三角锥形 |
| D、若AB3分子为三角锥形,则AB3分子一定为NH3 |
考点:判断简单分子或离子的构型
专题:化学键与晶体结构
分析:A、P和Cl是同一周期元素,中心原子磷是sp3杂化,形成三氯化磷是三角锥;
B、若AB3分子中的价电子个数为24个,可以推出来A为硼或铝,B为氟或氯,无论哪种组合都是平面正三角形;
C、若为A、B为同一主族元素,硫和氧形成的三氧化硫,硫是sp2杂化是平面正三角形;
D、若AB3分子为三角锥形,则AB3分子可能为NH3,也可能是PH3.
B、若AB3分子中的价电子个数为24个,可以推出来A为硼或铝,B为氟或氯,无论哪种组合都是平面正三角形;
C、若为A、B为同一主族元素,硫和氧形成的三氧化硫,硫是sp2杂化是平面正三角形;
D、若AB3分子为三角锥形,则AB3分子可能为NH3,也可能是PH3.
解答:
解:A、若A、B为同一周期元素的P和Cl元素,形成PCl3,中心原子磷是sp3杂化,是三角锥,故A错误;
B、若AB3分子中的价电子个数为24个,可以推出来A为硼或铝,B为氟或氯,无论哪种组合中心原子都是sp2杂化,无孤对电子对,分子都是平面正三角形,故B正确;
C、若为A、B为同一主族元素,硫和氧形成的三氧化硫,硫是sp2杂化是平面正三角形,故C错误;
D、若AB3分子为三角锥形,则AB3分子可能为NH3,也可能是PH3,故D错误;
故选B.
B、若AB3分子中的价电子个数为24个,可以推出来A为硼或铝,B为氟或氯,无论哪种组合中心原子都是sp2杂化,无孤对电子对,分子都是平面正三角形,故B正确;
C、若为A、B为同一主族元素,硫和氧形成的三氧化硫,硫是sp2杂化是平面正三角形,故C错误;
D、若AB3分子为三角锥形,则AB3分子可能为NH3,也可能是PH3,故D错误;
故选B.
点评:本题考查元素周期表结构,明确元素周期表中每一周期所含元素特点、种类等知识点即可解答,熟悉元素在周期表中的位置,题目难度不大.

练习册系列答案
相关题目
实验中需2mol/L的Na2CO3溶液950mL,配制时应选用的容量瓶的规格和称取Na2CO3的质量分别是( )
| A、1000mL,212g |
| B、950mL,543.4g |
| C、任意规格,572g |
| D、500mL,286g |
将AlCl3溶液中的Al3+沉淀出来,最好加入的试剂是( )
| A、氨水 |
| B、NaOH溶液 |
| C、Na2SO4溶液 |
| D、AgNO3溶液 |
制备乙酸乙酯的绿色合成路线之一为:
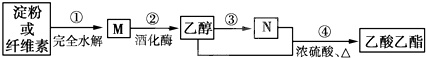
下列说法不正确的是( )

下列说法不正确的是( )
| A、M的分子式为C6H12O6 |
| B、用NaOH溶液可除去乙酸乙酯中混有的乙酸 |
| C、①、④的反应类型均属于取代反应 |
| D、N的化学式为CH3COOH |
X、Y、Z分别是短周期元素的三种单质,它们都是常见的金属或非金属.M、N、R是常见的三种氧化物.其中一种具有高熔点,而且有如下反应(条件未标出,方程未配平)若X是非金属,则组成Y单质的元素在周期表中的位置是( )
(1)X+Z→N; (2)M+X→N; (3)M+Y→R+X.
(1)X+Z→N; (2)M+X→N; (3)M+Y→R+X.
| A、第二周期ⅣA族 |
| B、第二周期ⅥA族 |
| C、第三周期ⅡA族 |
| D、第三周期ⅣA族 |
有100mL 3mol?L-1的氢氧化钠溶液和100mL 3mol?L-1的氯化铝溶液.按如下两种方法进行实验:①将氢氧化钠溶液分多次加入氯化铝溶液中;②将氯化铝溶液分多次加入氢氧化钠溶液中.比较两次实验的结果是( )
| A、现象相同,最终沉淀量相等 |
| B、现象不同,最终沉淀量不相等 |
| C、现象相同,最终沉淀量不相等 |
| D、现象不同,最终沉淀量相等 |

 ①若某金属M为第四周期单电子数最多的元素,该元素在周期表中的位置
①若某金属M为第四周期单电子数最多的元素,该元素在周期表中的位置