题目内容
 硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得:Na2SO3+S
硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得:Na2SO3+S
| ||
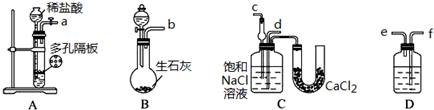
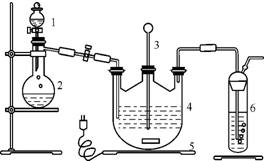
现按如下方法制备Na2S2O3?5H2O:将硫化钠和碳酸钠按反应要求比例一并放入三颈烧瓶中,注入150mL蒸馏水使其溶解,在分液漏斗中注入一种酸,在蒸馏烧瓶中加入亚硫酸钠固体,并按图安装好装置.
(1)分液漏斗中最好加入的酸是
A.浓硝酸 B.浓盐酸 C.18.4mol?L-1的硫酸 D.中等浓度的硫酸
(2)装置6的作用是
(3)打开分液漏斗活塞,注入酸使反应产生的二氧化硫气体较均匀地通入Na2S和Na2CO3的混合溶液中,并用磁力搅拌器搅动并加热,最终生成硫代硫酸钠.写出有中间产物Na2SO3生成的反应的化学方程式
(4)制得的粗晶体中往往含有少量杂质.为了测定粗产品中Na2S2O3的含量,一般采用在酸性条件下用KMnO4标准液滴定的方法(假定粗产品中杂质与酸性KMnO4溶液不反应).
称取1.28g粗样品溶于水,用0.40mol?L-1 KMnO4溶液(加入适量硫酸酸化)滴定,当溶液中S2O32-全部被氧化时,消耗KMnO4溶液体积20.00mL.(5S2O32-+8MnO4-+14H+═8Mn2++10SO42-+7H2O)
试回答:
①硫代硫酸钠溶液应置于
②滴定时是否需要加入指示剂?
③产品中的Na2S2O3质量分数为
考点:含硫物质的性质及综合应用,制备实验方案的设计
专题:氧族元素
分析:(1)制备二氧化硫用中等浓度的硫酸;
(2)二氧化硫属于有毒气体,要进行尾气处理;
(3)二氧化硫气体较均匀地通入Na2S和Na2CO3的混合溶液中,二氧化硫与碳酸钠反应生成亚硫酸钠和二氧化碳,与硫化钠反应生成亚硫酸钠和硫化氢;
(4)①硫代硫酸钠溶液呈碱性;
②高锰酸钾为紫色溶液;
③根据n=cV计算出1.28g样品消耗的高锰酸钾的物质的量,根据根据反应计算出样品中含有Na2S2O3?5H2O的物质的量,再根据质量分数的表达式计算出产品中Na2S2O3?5H2O的质量分数.
(2)二氧化硫属于有毒气体,要进行尾气处理;
(3)二氧化硫气体较均匀地通入Na2S和Na2CO3的混合溶液中,二氧化硫与碳酸钠反应生成亚硫酸钠和二氧化碳,与硫化钠反应生成亚硫酸钠和硫化氢;
(4)①硫代硫酸钠溶液呈碱性;
②高锰酸钾为紫色溶液;
③根据n=cV计算出1.28g样品消耗的高锰酸钾的物质的量,根据根据反应计算出样品中含有Na2S2O3?5H2O的物质的量,再根据质量分数的表达式计算出产品中Na2S2O3?5H2O的质量分数.
解答:
解:(1)二氧化硫易溶于水,所以不能用稀酸,浓硫酸中氢离子浓度很小,不利于与亚硫酸钠固体反应,所以制备二氧化硫用中等浓度的硫酸;
故答案为:D;
(2)二氧化硫属于有毒气体,要进行尾气处理,所以装置6的作用是吸收尾气中的二氧化硫,防止污染空气;
故答案为:吸收尾气中的二氧化硫;
(3)二氧化硫气体较均匀地通入Na2S和Na2CO3的混合溶液中,二氧化硫与碳酸钠反应生成亚硫酸钠和二氧化碳,则发生的反应为:Na2CO3+SO2═Na2SO3+CO2,二氧化硫与硫化钠反应生成亚硫酸钠和硫化氢,则反应的化学方程式为:Na2S+SO2+H2O═Na2SO3+H2S;
故答案为:Na2CO3+SO2═Na2SO3+CO2;Na2S+SO2+H2O═Na2SO3+H2S;
(4)①硫代硫酸钠溶液呈碱性,应该用碱式滴定管盛放,
故答案为:碱式;
②高锰酸钾为紫色溶液,根据高锰酸钾的颜色变化即可判断反应是否达到终点,所以不需要加指示剂;
故答案为:不需要;
③20mL 0.40mol/L KMnO4溶液中含有高锰酸钾的物质的量为:n(KMnO4)=0.40mol/L×0.02L=0.008mol,
根据反应5S2O32-+8MnO4-+14H+═8Mn2++10SO42-+7H2O可知,1.28g的粗样品含有Na2S2O3?5H2O的物质的量为:n(Na2S2O3?5H2O)=n(S2O32-)=
×n(KMnO4)=0.005mol,
产品中Na2S2O3?5H2O的质量分数为:
×100%=96.9%,
故答案为:96.9%.
故答案为:D;
(2)二氧化硫属于有毒气体,要进行尾气处理,所以装置6的作用是吸收尾气中的二氧化硫,防止污染空气;
故答案为:吸收尾气中的二氧化硫;
(3)二氧化硫气体较均匀地通入Na2S和Na2CO3的混合溶液中,二氧化硫与碳酸钠反应生成亚硫酸钠和二氧化碳,则发生的反应为:Na2CO3+SO2═Na2SO3+CO2,二氧化硫与硫化钠反应生成亚硫酸钠和硫化氢,则反应的化学方程式为:Na2S+SO2+H2O═Na2SO3+H2S;
故答案为:Na2CO3+SO2═Na2SO3+CO2;Na2S+SO2+H2O═Na2SO3+H2S;
(4)①硫代硫酸钠溶液呈碱性,应该用碱式滴定管盛放,
故答案为:碱式;
②高锰酸钾为紫色溶液,根据高锰酸钾的颜色变化即可判断反应是否达到终点,所以不需要加指示剂;
故答案为:不需要;
③20mL 0.40mol/L KMnO4溶液中含有高锰酸钾的物质的量为:n(KMnO4)=0.40mol/L×0.02L=0.008mol,
根据反应5S2O32-+8MnO4-+14H+═8Mn2++10SO42-+7H2O可知,1.28g的粗样品含有Na2S2O3?5H2O的物质的量为:n(Na2S2O3?5H2O)=n(S2O32-)=
| 5 |
| 8 |
产品中Na2S2O3?5H2O的质量分数为:
| 248g/mol×0.005mol |
| 1.28g |
故答案为:96.9%.
点评:本题通过Na2S2O3?5H2O的制备,考查了物质性质实验方案设计方法,题目难度中等,正确理解题干信息明确制备原理为解答此类题的关键,试题充分考查了学生的分析、理解能力及化学实验能力.

练习册系列答案
相关题目
含有下列各组离子的溶液中通入(或加入)过量的某种物质后仍能大量共存的是( )
| A、H+、Ba2+、Fe3+、NO3-,通入SO2气体 |
| B、Ca2+、Cl-、K+、H+,通入CO2气体 |
| C、AlO2-、Na+、Br-、SO42-,通入CO2气体 |
| D、HCO3-、Na+、I-、HS-,加入AlCl3溶液 |
NA表示阿伏伽德罗常数的值,下列叙述正确的是( )
| A、O2和O3的混合气体共6.4g,其中所含氧原子数一定为0.4NA |
| B、常温常压下,22.4L二氧化碳含有的原子总数为3NA |
| C、将标准状况下22.4L NO与11.2L O2混合后所含分子数为1.5NA |
| D、物质的量浓度为0.25mol?L-1的MgCl2溶液中含有Cl个数为0.5NA |
下列关于工业生产过程的叙述错误的是( )
| A、联合制碱法生产的两种产品一种是碱,一种是盐 |
| B、在硫酸工业生产过程的接触室中运用热交换技术可充分利用能源 |
| C、在合成氨生产中有原料循环使用的工艺,可以提高原料的利用率 |
| D、用烧碱溶液吸收精制硝酸产生的尾气中的氮氧化物符合绿色化学理念 |
下列有关生活中的化学,说法不正确的是( )
| A、石油裂解、煤的气化、海水制镁都包含化学变化来源 |
| B、福尔马林可制备标本是利用了使蛋白质变性的性质 |
| C、含钙、钡、铂等金属元素的物质有绚丽的颜色,可用于制造焰火 |
| D、红葡萄酒储藏时间长后变香可能是因为乙醇发生了酯化反应 |
某有机物在氧气中充分燃烧,生成等物质的量的水和二氧化碳,则该有机物一定满足条件( )
| A、该有机物的相对分子质量为28 |
| B、分子中C、H个数比为1:2 |
| C、分子中的C、H、O个数比为1:2:3 |
| D、该分子中肯定不含氧元素 |
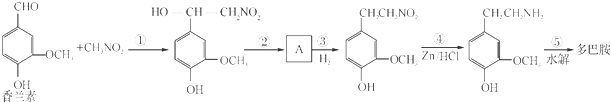
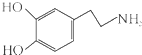 多巴胺是一种神经递质,用来帮助细胞传送脉冲的化学物质.这种脑内分泌物主要负责大脑的情感,将兴奋及开心的信息传递,使人感到愉悦和快乐.多巴胺可由香兰素与硝基甲烷缩合,再经锌还原水解而得,合成过程如下:
多巴胺是一种神经递质,用来帮助细胞传送脉冲的化学物质.这种脑内分泌物主要负责大脑的情感,将兴奋及开心的信息传递,使人感到愉悦和快乐.多巴胺可由香兰素与硝基甲烷缩合,再经锌还原水解而得,合成过程如下: