题目内容
有0.1mol?L-1的三种溶液:①CH3COOH、②NaOH、③CH3COONa,下列说法正确的是( )
| A、溶液①中,c(CH3COO-)=c(H+) |
| B、溶液①、②等体积混合,混合液中c(CH3COO-)等于溶液③中的c(CH3COO-) |
| C、溶液①、②等体积混合,混合液中c(CH3COO-)+c(CH3COOH)=c(Na+) |
| D、溶液①、③等体积混合,混合液中c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
考点:弱电解质在水溶液中的电离平衡,盐类水解的应用,离子浓度大小的比较
专题:电离平衡与溶液的pH专题,盐类的水解专题
分析:A.任何电解质溶液中都存在电荷守恒,根据电荷守恒判断;
B.溶液①、②等体积混合,二者恰好反应生成0.05mol/L的醋酸钠,浓度越小,醋酸根离子浓度越小;
C.溶液①、②等体积混合,二者恰好反应生成0.05mol/L的醋酸钠,溶液中存在物料守恒,根据物料守恒判断;
D.溶液①、③等体积混合,醋酸的电离程度大于醋酸根离子水解程度,溶液呈酸性,再结合电荷守恒判断.
B.溶液①、②等体积混合,二者恰好反应生成0.05mol/L的醋酸钠,浓度越小,醋酸根离子浓度越小;
C.溶液①、②等体积混合,二者恰好反应生成0.05mol/L的醋酸钠,溶液中存在物料守恒,根据物料守恒判断;
D.溶液①、③等体积混合,醋酸的电离程度大于醋酸根离子水解程度,溶液呈酸性,再结合电荷守恒判断.
解答:
解:A.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(CH3COO-)+c(OH-)=c(H+),故A错误;
B.溶液①、②等体积混合,二者恰好反应生成0.05mol/L的醋酸钠,浓度越小,醋酸根离子浓度越小,所以混合液中c(CH3COO-)小于溶液③中的c(CH3COO-),故B错误;
C.溶液①、②等体积混合,二者恰好反应生成0.05mol/L的醋酸钠,溶液中存在物料守恒,根据物料守恒得c(CH3COO-)+c(CH3COOH)=c(Na+),故C正确;
D.溶液①、③等体积混合,醋酸的电离程度大于醋酸根离子水解程度,溶液呈酸性,c(H+)>c(OH-),根据电荷守恒得c(H+)+c(Na+)=c(CH3COO-)+c(OH-),所以c(Na+)<c(CH3COO-),故D错误;
故选C.
B.溶液①、②等体积混合,二者恰好反应生成0.05mol/L的醋酸钠,浓度越小,醋酸根离子浓度越小,所以混合液中c(CH3COO-)小于溶液③中的c(CH3COO-),故B错误;
C.溶液①、②等体积混合,二者恰好反应生成0.05mol/L的醋酸钠,溶液中存在物料守恒,根据物料守恒得c(CH3COO-)+c(CH3COOH)=c(Na+),故C正确;
D.溶液①、③等体积混合,醋酸的电离程度大于醋酸根离子水解程度,溶液呈酸性,c(H+)>c(OH-),根据电荷守恒得c(H+)+c(Na+)=c(CH3COO-)+c(OH-),所以c(Na+)<c(CH3COO-),故D错误;
故选C.
点评:本题考查了离子浓度大小的判断,根据溶液中溶质的性质结合电荷守恒和物料守恒解答,易错选项是B,注意B选项中溶液体积增大一倍,导致浓度降为③的一半,为易错点.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
常温下,有关下列4种溶液的说法正确的是( )
| ① | ② | ③ | ④ |
| 0.1mol?L-1氨水 | Ph=11 氨水 |
0.1mol?L-1 盐酸 |
pH=3 盐酸 |
| A、由水电离出的c(H+):③>① |
| B、①稀释到原来的100倍,pH与②相同 |
| C、①与③混合,若溶液pH=7,则溶液中c(NH4+)>C(Cl-) |
| D、②与④等体积混合,混合液pH>7 |
下列有关实验装置进行的相应实验,能达到实验目的是( )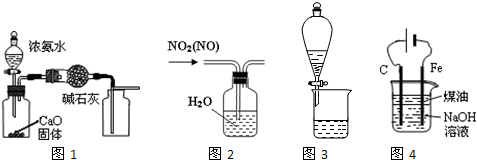

| A、用图1装置制取并收集干燥纯净的NH3 |
| B、用图2所示装置可除去NO2中的NO |
| C、用图3所示装置可分离CH3COOC2H5和饱和碳酸钠溶液 |
| D、用图4装置制备Fe(OH)2并能较长时间观察其颜色 |
某无色酸性溶液中,则该溶液中一定能够大量共存的离子组是( )
| A、Fe2+、Ba2+、NO3-、Cl- |
| B、Na+、NH4+、SO42-、Cl- |
| C、Na+、K+、SO32-、NO3- |
| D、Na+、K+、MnO4-、Br- |
在下述条件下,一定能大量共存的离子组是( )
| A、无色透明的水溶液中:K+、Ba2+、I-、MnO4- |
| B、含有大量NO3-的水溶液中:NH4+、Fe2+、SO42-、H+ |
| C、能与Al反应产生H2的溶液中:HCO3-、Na+、Al3+、Br- |
| D、常温下pH=1的溶液中:Mg2+、Cl-、SO42-、Fe3+ |
下列说法正确的是( )
| A、常温下0.1 mol/L的下列溶液①NH4Al(SO4)2、②NH4Cl、③NH3?H2O、④CH3COONH4溶液中c(NH4+)由大到小的顺序是:②>①>④>③ |
| B、常温下0.4 mol/L HB溶液 和0.2 mol/L NaOH溶液等体积混合后溶液的pH=3,则溶液中离子浓度大小顺序为:c(HB)>c(Na+)>c(B-)>c(H+)>c(OH-) |
| C、pH=2的CH3COOH溶液和HCl溶液、pH=12的氨水和NaOH溶液,相同温度时,四种溶液中由水电离的c(H+)相等 |
| D、用惰性电极电解足量的CuSO4溶液一段时间,加入一定量的Cu(OH)2可以恢复至原来的浓度和体积 |
设NA表示阿伏加德罗常数,下列叙述正确的是( )
| A、常温下,23g NO2含有NA个氧原子 |
| B、25℃、101.3kPa时,11.2L H2中含有的原子数为NA |
| C、标准状况下,22.4L H2O中含有的分子数为NA |
| D、2.3g的金属钠变为钠离子时失去的电子数为0.1NA |
 在①CO2、②NO2、③CO、④Cl2、⑤HCl、⑥NH3等气体中(选填序号)
在①CO2、②NO2、③CO、④Cl2、⑤HCl、⑥NH3等气体中(选填序号) 白云石(主要成分为CaCO3,MgCO3)可用作碱性耐火材料和高炉炼铁的溶制等.
白云石(主要成分为CaCO3,MgCO3)可用作碱性耐火材料和高炉炼铁的溶制等.