题目内容
7.在100ml1mol/L的AlCl3溶液中滴加的1mol/LNaOH溶液可得到3.9沉淀,则消耗的NaOH溶液的体积是多少?分析 AlCl3和NaOH反应与NaOH的量的多少有关,当NaOH不足时生成Al(OH)3,当碱过量时,则生成NaAlO2.现AlCl3的物质的量为0.1mol,完全生成Al(OH)3沉淀时,沉淀质量应为7.8g,现沉淀质量为3.9g,说明有两种情况:一为沉淀不完全,只生成Al(OH)3沉淀;另一种情况为沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2.
解答 解:现AlCl3的物质的量为0.1mol,完全生成Al(OH)3沉淀时,沉淀质量应为7.8g,现沉淀质量为3.9g,说明有两种情况:一为沉淀不完全,只生成Al(OH)3沉淀;另一种情况为沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2,
n(Al(OH)3)=$\frac{3.9g}{78g/mol}$=0.05mol,
①若碱不足,由Al3++3OH-═Al(OH)3↓可知,
NaOH的物质的量为0.05mol×3=0.15mol,
加入NaOH溶液的体积为$\frac{0.15mol}{1mol/L}$=0.15L,即150mL;
②沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2,
则由 Al3++3OH-═Al(OH)3↓
0.1mol 0.3mol 0.1mol
Al(OH)3 +OH-═AlO2-+2H2O
(0.1-0.05)mol (0.1-0.05)mol
则消耗的碱的物质的量为0.3mol+(0.1-0.05)mol=0.35mol,
加入NaOH溶液的体积为$\frac{0.35mol}{1mol/L}$=0.35L,即350mL;
答:消耗的NaOH溶液的体积是150 ml和350 ml.
点评 本题考查铝的计算,题目难度中等,本题的解答关键是根据100mL1mol/L的AlCl3溶液、1mol/L的NaOH溶液,以及3.9g沉淀,结合反应的有关方程式计算.

 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案| A. | NaAlO2溶液中通入少量二氧化碳:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| B. | NaOH溶液中通入少量二氧化碳:2OH-+CO2═CO32-+H2O | |
| C. | AlCl3溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| D. | AlCl3溶液中加入过量NaOH溶液:Al3++3OH-═Al(OH)3↓ |
| A. | 1.98 kg | B. | 2.00 kg | C. | 2.22 kg | D. | 2.42 kg |
| A. | 氯原子的结构示意图: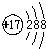 | |
| B. | 硫酸的电离方程式:H2SO4═H2++SO42- | |
| C. | 苏打粉的化学式:NaHCO3 | |
| D. | 明矾的化学式:KAl(SO4)2•12H2O |
| A. | 向样品溶液中逐渐加入少量锌粉,开始时未见产生气泡,样品溶液中一定不存在稀硫酸 | |
| B. | 向样品溶液中加入一定质量的铁粉后,充分反应后,有残余固体且质量比原加入的铁粉多,样品溶液中一定含有硫酸铜 | |
| C. | 向样品溶液中加入铜片,铜片溶解,溶液中一定含有硫酸铁 | |
| D. | 向样品溶液中逐滴滴入氢氧化钠,当滴入一定量后才观察到有浑浊现象,则样品溶液中一定含有稀硫酸 |
| A. | 氢气通过灼热的CuO粉末 | B. | 将锌粒投入Cu(NO3)2溶液 | ||
| C. | CO高温下还原Fe2O3 | D. | 二氧化碳通过Na2O2粉末 |
| A. | 1:1:1 | B. | 1:2:3 | C. | 6:3:2 | D. | 2:3:6 |
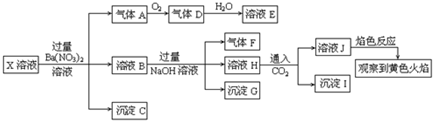
下列结论正确的是( )
| A. | X中肯定存在Na+、Fe2+、A13+、NH4+、SO42- | |
| B. | 气体F经催化氧化可直接生成气体D | |
| C. | 沉淀C一定是BaSO4、沉淀G一定是Fe(OH)3、沉淀I可能有Al(OH )3 | |
| D. | X中不能确定的离子有Na+、K+和C1- |