题目内容
下列各组离子,能在溶液中大量共存的是( )
| A、Na+、Al3+、AlO2-、Br- |
| B、H+、Fe2+、SO42-、NO3- |
| C、K+、NH4+、CO32-、OH- |
| D、Ca2+、Al3+、NO3-、Cl- |
考点:离子共存问题
专题:
分析:A.铝离子、偏铝酸根离子之间发生双水解反应生成氢氧化铝沉淀;
B.硝酸根离子在酸性条件下具有强氧化性,能够氧化亚铁离子;
C.铵根离子与氢氧根离子反应生成弱电解质一水合氨;
D.Ca2+、Al3+、NO3-、Cl-离子之间不满足离子反应发生条件.
B.硝酸根离子在酸性条件下具有强氧化性,能够氧化亚铁离子;
C.铵根离子与氢氧根离子反应生成弱电解质一水合氨;
D.Ca2+、Al3+、NO3-、Cl-离子之间不满足离子反应发生条件.
解答:
解:A.Al3+、AlO2-发生双水解反应生成氢氧化铝沉淀,在溶液中不能大量共存,故A错误;
B.NO3-在大量H+存在条件下能够氧化Fe2+,在溶液中不能大量共存,故B错误;
C.NH4+、OH-之间反应生成一水合氨,在溶液中不能大量共存,故C错误;
D.Ca2+、Al3+、NO3-、Cl-离子之间不发生反应,在溶液中能够大量共存,故D正确;
故选D.
B.NO3-在大量H+存在条件下能够氧化Fe2+,在溶液中不能大量共存,故B错误;
C.NH4+、OH-之间反应生成一水合氨,在溶液中不能大量共存,故C错误;
D.Ca2+、Al3+、NO3-、Cl-离子之间不发生反应,在溶液中能够大量共存,故D正确;
故选D.
点评:本题考查离子共存的正误判断,为高考中的高频题,题目难度中等,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间; 能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;试题有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
相关题目
运动会上使用的发令枪所用的“火药”成分是氯酸钾和红磷,经撞击发出响声,同时产生白色烟雾.撞击时发生反应的化学方程式为:5KClO3+6P═3P2O5+5KCl,则下列有关叙述错误的是( )
| A、上述反应中氧化剂和还原剂的物质的量之比为5:6 |
| B、产生白色烟雾的原因是生成的P2O5白色固体小颗粒(烟)吸水性很强,吸收空气中的水分,生成磷酸小液滴(雾) |
| C、上述反应中消耗3 mol P时,转移电子的物质的量为10mol |
| D、上述火药中的红磷可以用白磷代替 |
下列醇类物质中,不能被氧化成醛的是( )
| A、CH3-CH2-CH2-OH |
| B、CH3-CH2-OH |
C、 |
D、 |
性质决定用途,化学知识运用得当可以使人类的生活更美好.下列物质性质与应用的对应关系正确的是( )
| A、晶体硅熔点高硬度大,可用于制作半导体材料 |
| B、浓硫酸具有酸性,可用于刻蚀玻璃制品 |
| C、漂白粉在空气中不稳定,可用于漂白纸张 |
| D、氢氧化铝具有弱碱性,可用于制胃酸中和剂 |
下列各组中的离子,能在溶液中大量共存的是( )
| A、Na+、H+、Cl-、CO32- |
| B、Na+、Ca2+、CO32-、NO3- |
| C、Na+、Ca2+、Cl-、NO3- |
| D、K+、H+、SO42-、OH- |
在11Na、12Mg、13Al、14Si、15P、16S、17Cl、18Ar八种元素中,能用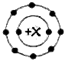 表示核外电子排布的常见阳离子共有( )
表示核外电子排布的常见阳离子共有( )
 表示核外电子排布的常见阳离子共有( )
表示核外电子排布的常见阳离子共有( )| A、1种 | B、2种 | C、3种 | D、4种 |
对于Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2(g)△H<0 的化学反应下列叙述不正确的是( )
A、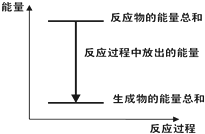 反应过程中能量关系可用如图表示 |
| B、△H的值与反应方程式的计量系数有关 |
| C、若将该反应设计成原电池锌为负极 |
| D、若将其设计为原电池当有32.5g锌溶解时,正极放出气体一定为11.2L |
NA为阿伏加德罗常数,下列说法正确的是( )
| A、标准状况下,5.6L氯气和16.8L氧气的混合气体中含有分子数为NA |
| B、标准状况下,22.4LH2O所含有原子数为3NA |
| C、NA个N2分子所占的体积与0.5 NA个H2分子所占的体积比一定是2:1 |
| D、常温下,2.3g Na完全与O2反应失去的电子数为0.2NA |