题目内容
11.下列有关物质的性质和该性质的应用均正确的是( )| A. | 氨气具有氧化性,用浓氨水检验Cl2管道是否泄漏 | |
| B. | 氢氟酸具有强酸性,用氢氟酸蚀刻玻璃 | |
| C. | 常温下浓硫酸与铝发生钝化,可在常温下用铝制容器贮藏贮运浓硫酸 | |
| D. | 钠的金属性比钾强,工业上用钠制取钾(Na+KCl$\frac{\underline{\;850℃\;}}{\;}$ K↑+NaCl) |
分析 A.根据用浓氨水检验Cl2管道是否泄漏的反应式为3Cl2+8NH3=N2+6NH4Cl来分析;
B.氢氟酸为弱酸;
C.常温下,浓硫酸和铝发生钝化现象,在铝的表面形成致密的氧化膜;
D.钠的金属性比钾弱.
解答 解:A.在反应3Cl2+8NH3=N2+6NH4Cl中,氨气做还原剂,表现还原性,故A错误;
B.氢氟酸为弱酸,不具有强酸性,氢氟酸能与玻璃中二氧化硅反应,所以用氢氟酸蚀刻玻璃,故B错误;
C.常温下,浓硫酸和铝发生氧化还原反应而生成一层致密的氧化物薄膜而阻止进一步被氧化,该现象为钝化现象,常温下用铝制容器贮藏贮运浓硫酸,故C正确;
D.钠的金属性比钾弱,工业上用钠制取钾(Na+KCl$\frac{\underline{\;850℃\;}}{\;}$ K↑+NaCl),是因为K的沸点比Na的低,分离出钾蒸汽,反应不断向正方向进行,故D错误;
故选:C.
点评 本题考查了元素化合物知识,熟悉氨气、氢氟酸、铝、Na、K的性质是解题关键,注意铝与冷的浓硝酸的钝化反应,题目难度不大,侧重于考查学生的分析、应用能力.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案
相关题目
19.工业上冶炼金属一般用热分解法、热还原法和电解法.采用的不同的冶炼方法.你认为选择的原则主要是依据( )
| A. | 金属熔点的高低 | B. | 金属阳离子得电子的能力 | ||
| C. | 金属在自然界的存在形式 | D. | 金属元素在地壳中的含量 |
6.下列关于NA说法正确的是( )
| A. | 1 mol的羟基与1 mol的氢氧根离子所含电子数均为9NA | |
| B. | 标准状况下,2.24 L Cl2与氢氧化钠溶液完全反应转移电子数为0.1NA | |
| C. | 1 mol NaCl中含有6.02×1023个NaCl分子 | |
| D. | 25℃时pH=13的NaOH溶液中含有OH-的数目为0.1NA |
16.电离平衡常数是衡量弱电解质电离程度的量.已知如表数据(25℃):
(1)25℃时,等浓度的三种溶液(A.NaCN溶液、B.Na2CO3溶液、C.CH3COONa溶液)的pH由大到小的顺序为b>a>c.(填写序号)
(2)25℃时,向NaCN溶液中通入少量CO2,所发生反应的化学方程式为NaCN+CO2+H2O=NaHCO3+HCN.
(3)现有浓度为0.02mol/L的HCN与0.01mol/L NaOH等体积混合后,测得c(Na+)>c(CN-),下列关系正确的是B、D.
A.c(H+)>c(OH-)
B.c(H+)<c(OH-)
C.c(H+)+c(HCN)=c(OH-)
D.c(HCN)+c(CN-)=0.01mol/L
(4)浓的Al2(SO4)3溶液和浓的小苏打(NaHCO3)溶液混合可用于灭火,请用离子反应方程式表示灭火的原理Al3++3HCO3-=Al(OH)3↓+3CO2↑.
(5)已知NaHC2O4水溶液显酸性,请写出该溶液中各离子浓度的大小c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-);电荷守恒表达式c(OH-)+c(HC2O4-)+2c (C2O42-)=c(H+)+c(Na+).
(6)H2C2O4溶液和KMnO4酸性溶液可发生反应:H2C2O4+MnO4-+H+→CO2+Mn2++H2O,反应中每生成标况下4.48LCO2气体,转移的电子的物质的量为0.2mol.
| 化学式 | 电离平衡常数 |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.4×10-7,K2=4.7×10-11 |
(2)25℃时,向NaCN溶液中通入少量CO2,所发生反应的化学方程式为NaCN+CO2+H2O=NaHCO3+HCN.
(3)现有浓度为0.02mol/L的HCN与0.01mol/L NaOH等体积混合后,测得c(Na+)>c(CN-),下列关系正确的是B、D.
A.c(H+)>c(OH-)
B.c(H+)<c(OH-)
C.c(H+)+c(HCN)=c(OH-)
D.c(HCN)+c(CN-)=0.01mol/L
(4)浓的Al2(SO4)3溶液和浓的小苏打(NaHCO3)溶液混合可用于灭火,请用离子反应方程式表示灭火的原理Al3++3HCO3-=Al(OH)3↓+3CO2↑.
(5)已知NaHC2O4水溶液显酸性,请写出该溶液中各离子浓度的大小c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-);电荷守恒表达式c(OH-)+c(HC2O4-)+2c (C2O42-)=c(H+)+c(Na+).
(6)H2C2O4溶液和KMnO4酸性溶液可发生反应:H2C2O4+MnO4-+H+→CO2+Mn2++H2O,反应中每生成标况下4.48LCO2气体,转移的电子的物质的量为0.2mol.
3.下列物质中,可以作为食品防腐剂的是( )
| A. | L-谷氨酸钠 | B. | 苯甲酸钠 | C. | 碳酸氢钠 | D. | 醋酸 |
20.下列离子方程式书写正确的是( )
| A. | 已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量CO2,2ClO-+CO2+H2O═2HClO+CO32- | |
| B. | 向Fe(NO3)2和NaBr混合溶液中滴加稀盐酸:6Br-+8H++2NO3-═3Br2+2NO↑+4H2O | |
| C. | 在硫酸氢钾溶液中加入氢氧化钡溶液至pH=7,Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| D. | 双氧水使酸性KMnO4溶液褪色:2MnO4-+5H2O2═2Mn2++5O2↑+6OH-+2H2O |
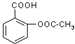 试根据阿斯匹林的结构回答;
试根据阿斯匹林的结构回答; ,其分子式为C7H6O3,则B的结构简式为CH3COOH;
,其分子式为C7H6O3,则B的结构简式为CH3COOH;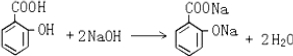 .
.