题目内容
18.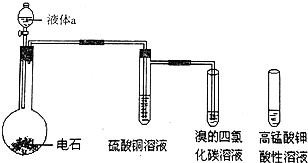 如图是实验室制取乙炔气体及乙炔的性质实验的装置,气密性已检验,部分夹持装置略.
如图是实验室制取乙炔气体及乙炔的性质实验的装置,气密性已检验,部分夹持装置略.(1)实验室制取乙炔时,分液漏斗中的液体a通常是饱和食盐水;
(2)圆底烧瓶中生成乙炔的化学方程式是CaC2+2H2O→Ca(OH)2+CH≡CH↑;
(3)硫酸铜溶液的作用是除去乙炔气体中可能混有的杂质(H2S、AsH3等);
(4)将通过硫酸铜溶液的气体通入溴的四氯化碳溶液中,反应的方程式是CH≡CH+2Br2→CHBr2CHBr2;
若改为通入酸性高锰酸钾溶液中,现象是高锰酸钾溶液紫红色褪去;
(5)乙炔与氯化氢加成可以生成氯乙烯聚合生成聚氯乙烯的方程式是nCH2=CHCl$\stackrel{一定条件}{→}$
 .
.
分析 实验室常用块状固体碳化钙(CaC2)与水反应生成氢氧化钙[Ca(OH)2]和乙炔,由于该反应很难控制反应速率,故采用饱和食盐水代替水进行制取,乙炔中含有碳碳三键,能发生加成反应,加聚反应,还能使高锰酸钾溶液褪色,据此解即可.
解答 解:(1)实验室中为缓解此反应的速率,常用饱和食盐水代替水反应制取,故答案为:饱和食盐水;
(2)碳化钙(CaC2)与水反应生成氢氧化钙[Ca(OH)2]和乙炔,方程式为:CaC2+2H2O→Ca(OH)2+CH≡CH↑,故答案为:CaC2+2H2O→Ca(OH)2+CH≡CH↑;
(3)乙炔中常混有杂质气体硫化氢等,硫化氢与硫酸铜反应生成硫化铜沉淀,离子反应方程式为:H2S+Cu2+=CuS↓+2H+,故答案为:除去乙炔气体中可能混有的杂质(H2S、AsH3等);
(4)乙炔中含有碳碳三键,与溴发生加成反应,化学反应方程式为:CH≡CH+2Br2→CHBr2CHBr2,乙炔容易被高锰酸钾氧化,使高锰酸钾褪色;故答案为:CH≡CH+2Br2→CHBr2CHBr2;高锰酸钾溶液紫红色褪去;
(5)氯乙烯制取聚氯乙烯化学方程式:nCH2=CHCl$\stackrel{一定条件}{→}$ ,发生的是加聚反应,故答案为:nCH2=CHCl$\stackrel{一定条件}{→}$
,发生的是加聚反应,故答案为:nCH2=CHCl$\stackrel{一定条件}{→}$ .
.
点评 本题考查乙炔的实验室制法及其性质,侧重基础知识的考查,利用所学知识即可完成,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.已知X、Y、Z三种短周期元素在周期表中的位置如图所示,设X的原子序数为a.则下列说法正确的是( )
| Y | ||
| X | ||
| Z |
| A. | Y是非金属性最强的元素 | B. | Z是金属元素 | ||
| C. | Y的原子序数为a-7 | D. | X的气态氢化物化学式为H2X |
9.下列离子方程式正确的是( )
| A. | 向Ba(OH)2溶液中滴加稀硫酸:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| B. | 将Na块投入水中,产生气体:Na+2H2O═Na++2OH-+H2↑ | |
| C. | 0.1 mol•L-1亚硫酸氢钠溶液的pH约为3:HSO3-+H2O═SO32-+H3O+ | |
| D. | 向Al2(SO4)3溶液中加入过量的NH3•H2O:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ |
6.配制100mL 1.0mol/LNa2CO3溶液,下列操作正确的是( )
| A. | 称取10.6 g无水碳酸钠,加入100 mL容量瓶中,加水溶解、定容 | |
| B. | 定容后,塞好瓶塞,反复倒转、摇匀 | |
| C. | 转移Na2CO3溶液时,未用玻璃棒引流,直接倒入容量瓶中 | |
| D. | 称取10.6 g无水碳酸钠,加入100 mL蒸馏水,搅拌、溶解 |
3.X、Y、Z、V、W是元素周期表前四周期中的五种常见元素,其相关信息如下表:
(1)X位于第二周期IVA族.W的核外电子排布式为1s22s22p63s23p63d64s2.
(2)Y、Z、V对应简单离子半径由大到小的顺序为S2->O2->Na+.(书写离子符号),写出Z2Y2与水反应的离子方程式2Na2O2+2H2O=4Na++4OH-+O2↑.
(3)X和V形成的化合物是一种无色液体,其合成方法之一是一定条件下用含氢质量分数最大的有机物和V的单质为原料,同时生成一种臭鸡蛋气味的气体.请写出化学反应方程式:
(4)已知W2Y3(s)+3XY(g)=2W(s)+3XY2(g)△H=-26.7kJ•mol-1
3W2Y3(s)+XY(g)=2W3Y4(s)+XY2(g)△H=-50.75kJ•mol-1
W3Y4(s)+XY(g)=3WY(s)十XY2(g)△H=-36.5kJ•mol-1
则相同,反应WY(s)+XY(g)=W(s)+XY2(g)△H=+7.3 kJ•mol-1.
| 元素 | 相关信息 |
| X | X是形成化合物类最多,它一气态氧化物能产生温室效应 |
| Y | Y是地壳中含量最多的元素 |
| Z | Z和Y形成一化合物Z2Y2为淡黄色粉末,可作为呼吸面具里氧气来源 |
| V | V的单质是淡黄色固体,是黑火药一主要成分 |
| W | 日常生活中应用最广泛的金属之一,且W有几种不同价态的氧化物,其中一种有磁性 |
(2)Y、Z、V对应简单离子半径由大到小的顺序为S2->O2->Na+.(书写离子符号),写出Z2Y2与水反应的离子方程式2Na2O2+2H2O=4Na++4OH-+O2↑.
(3)X和V形成的化合物是一种无色液体,其合成方法之一是一定条件下用含氢质量分数最大的有机物和V的单质为原料,同时生成一种臭鸡蛋气味的气体.请写出化学反应方程式:
(4)已知W2Y3(s)+3XY(g)=2W(s)+3XY2(g)△H=-26.7kJ•mol-1
3W2Y3(s)+XY(g)=2W3Y4(s)+XY2(g)△H=-50.75kJ•mol-1
W3Y4(s)+XY(g)=3WY(s)十XY2(g)△H=-36.5kJ•mol-1
则相同,反应WY(s)+XY(g)=W(s)+XY2(g)△H=+7.3 kJ•mol-1.
10.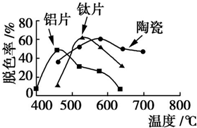 在不同的载体(钛片、铝片、陶瓷)表面制备TiO2薄膜,探究不同载体下TiO2薄膜光催化使甲基橙脱色的效果,每光照20min取一次样,实验结果如图所示.下列说法正确的是( )
在不同的载体(钛片、铝片、陶瓷)表面制备TiO2薄膜,探究不同载体下TiO2薄膜光催化使甲基橙脱色的效果,每光照20min取一次样,实验结果如图所示.下列说法正确的是( )
 在不同的载体(钛片、铝片、陶瓷)表面制备TiO2薄膜,探究不同载体下TiO2薄膜光催化使甲基橙脱色的效果,每光照20min取一次样,实验结果如图所示.下列说法正确的是( )
在不同的载体(钛片、铝片、陶瓷)表面制备TiO2薄膜,探究不同载体下TiO2薄膜光催化使甲基橙脱色的效果,每光照20min取一次样,实验结果如图所示.下列说法正确的是( )| A. | 不同载体,无论何种温度一定是钛片载体的光催化活性最好 | |
| B. | 无论何种载体,催化活性总是随温度的升高而升高 | |
| C. | 约在520℃时,钛片载体的光催化活性最好 | |
| D. | 不同载体,TiO2薄膜的光催化活性相同 |
7.实验室配制250ml 0.200mol/L NaCl溶液,下列操作导致所配溶液浓度偏低的是( )
| A. | 容量瓶洗净后未干燥 | |
| B. | 移液后烧杯未洗涤 | |
| C. | 定容时俯视读数 | |
| D. | 摇匀后液面低于刻度线再滴加水至刻度线 |