题目内容
16.如图是元素周期表的一部分,回答下列问题: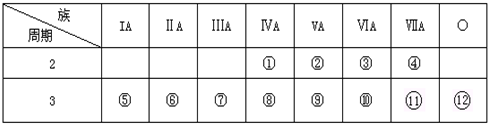
(1)写出①、②两种元素的名称碳,氮;⑧、⑨两种元素的符号Si,P.
(2)在这些元素中,Na(用元素符号填写,下同)是最活泼的金属元素;F是最活泼的非金属元素.
(3)这些元素的最高价氧化物的对应水化物中HClO4酸性最强;NaOH碱性最强;能形成两性氢氧化物的元素是Al.
(4)写出①的最高价氧化物的结构式O=C=O.
(5)比较⑤与⑥的化学性质,Na更活泼,试用实验证明此现象(简述操作、现象和结论).
分析 (1)由元素在周期表中位置,可知①为C、②为N、③为O、④为F、⑤为Na、⑥为Mg、⑦为Al、⑧为Si、⑨为P、⑩为S、⑪为Cl、⑫为Ar;
(2)同周期自左而右元素金属性减弱、非金属性增强,同主族自上而下元素金属性增强、非金属性减弱;
(3)高氯酸的酸性最强,上述元素中Na的金属性最强,故氢氧化钠碱性最强,氢氧化铝属于两性氢氧化物;
(4)①的最高价氧化物为CO2,分子中碳原子与氧原子之间形成2对共用电子对;
(5)自左而右金属活泼性逐渐减弱,金属钠和冷水反应而金属镁不反应.
解答 解:(1)由元素在周期表中位置,可知①为C、②为N、③为O、④为F、⑤为Na、⑥为Mg、⑦为Al、⑧为Si、⑨为P、⑩为S、⑪为Cl、⑫为Ar,
故答案为:碳;氮;Si;P;
(2)同周期自左而右,素金属性减弱、非金属性增强,同主族自上而下金属性增强、非金属性减弱,故最活泼金属为Na,最活泼非金属为F,
故答案为:Na;F;
(3)F无最高正价,最高价含氧酸中酸性最强是HClO4,Na的金属性最强,故NaOH的碱性最强,Al元素的氢氧化物--氢氧化铝属于两性氢氧化物,
故答案为:HClO4;NaOH;Al;
(4)①的最高价氧化物为CO2,分子中碳原子与氧原子之间形成2对共用电子对,结构式为O=C=O,
故答案为:O=C=O;
(5)⑤和⑥分别是Na和Mg,金属性Na>Mg,可依据二者单质分别与水反应的剧烈程度来判断其金属性强弱,金属钠和金属镁的单质分别与冷水反应,反应剧烈程度大的是金属钠,反之是金属镁,
故答案为:Na;金属钠和金属镁的单质分别与冷水反应,反应剧烈程度大的是金属钠,反之是金属镁.
点评 本题考查元素周期表与元素周期律,难度不大,注意把握元素周期表的结构及元素周期律的理解.

练习册系列答案
相关题目
15.某化合物的水溶液能导电,且溶液中不存在电解质分子,但该化合物属于非电解质,符合该条件的物质是( )
| A. | Cl2 | B. | NH3 | C. | SO3 | D. | Na2O |
16.在试管的内壁附着下列物质,用稀盐酸浸泡而不能除去的是( )
| A. | 用足量一氧化碳还原氧化铁后留下的物质 | |
| B. | 硫酸铁溶液与氢氧化钠溶液反应后留下的红褐色固体 | |
| C. | 盛石灰水后留下的白色固体 | |
| D. | 用足量氢气还原氧化铜后留下的红色物质 |
11.L、M、R、T、W是原子序数依次增大的短周期主族元素,M、T在周期表中的相对位置如表:L与R原子的最外层电子数相同,R的单质是一种常见的半导体材料.请回答下列问题:
(1)T原子的结构示意图为 ,元素W在周期表中位于第三周期第ⅦA族,M单质分子的电子式为
,元素W在周期表中位于第三周期第ⅦA族,M单质分子的电子式为 .
.
(2)R是组成玻璃的元素之一,不能用带磨口玻璃塞的试剂瓶放氢氧化钠溶液的原因是(用化学方程式表示)SiO2+2NaOH═Na2SiO3+H2O.
(3)下列有关相应元素非金属性强弱比较的说法,正确的是(填序号)acd.
a.M的气态氢化物比R的气态氢化物稳定,则非金属性M强于R
b.高温下L的单质能从R的最高价氧化物中置换出R,则非金属性L强于R
c.W的核电荷数比T多,原子半径比T小,得电子能力强,则非金属性W强于T
d.同温、同物质的量浓度的Na2LO3和Na2TO4溶液pH:Na2LO3>Na2TO4,则非金属性T强于L
(4)工业上可用二氧化硅、氯气和焦炭在高温条件下制备RW4,该反应中除RW4外的另一种产物可以用于工业冶炼铁.制备RW4反应的化学方程式为2Cl2+SiO2+2C$\frac{\underline{\;高温\;}}{\;}$SiCl4+2CO.
| M | |
| T |
 ,元素W在周期表中位于第三周期第ⅦA族,M单质分子的电子式为
,元素W在周期表中位于第三周期第ⅦA族,M单质分子的电子式为 .
.(2)R是组成玻璃的元素之一,不能用带磨口玻璃塞的试剂瓶放氢氧化钠溶液的原因是(用化学方程式表示)SiO2+2NaOH═Na2SiO3+H2O.
(3)下列有关相应元素非金属性强弱比较的说法,正确的是(填序号)acd.
a.M的气态氢化物比R的气态氢化物稳定,则非金属性M强于R
b.高温下L的单质能从R的最高价氧化物中置换出R,则非金属性L强于R
c.W的核电荷数比T多,原子半径比T小,得电子能力强,则非金属性W强于T
d.同温、同物质的量浓度的Na2LO3和Na2TO4溶液pH:Na2LO3>Na2TO4,则非金属性T强于L
(4)工业上可用二氧化硅、氯气和焦炭在高温条件下制备RW4,该反应中除RW4外的另一种产物可以用于工业冶炼铁.制备RW4反应的化学方程式为2Cl2+SiO2+2C$\frac{\underline{\;高温\;}}{\;}$SiCl4+2CO.
1.如图为元素周期表短周期的一部分,下列有关A、B、C、D四种元素的叙述中不正确的是( )


| A. | A、C两元素形成的化合物都为共价化合物 | |
| B. | AD2的电子式为 | |
| C. | B、C形成的化合物BC中所含化学键为非极性共价键 | |
| D. | B2的结构式为N≡N |
5.下列各项表达中正确的是( )
| A. | Na2O2的电子式为 | B. | H2S2的结构式:H-S-S-H | ||
| C. | 原子核内有8个中子的碳原子148C | D. | NH4Cl的电子式: |

 碳碳双键
碳碳双键  羰基
羰基  酯基.
酯基.