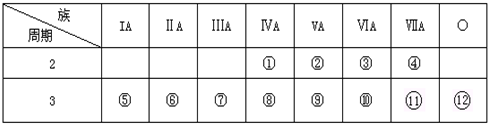
题目内容
5.下列各项表达中正确的是( )| A. | Na2O2的电子式为 | B. | H2S2的结构式:H-S-S-H | ||
| C. | 原子核内有8个中子的碳原子148C | D. | NH4Cl的电子式: |
分析 A.过氧根离子中为O-O单键,不是O=O双键;
B.类比双氧水的结构判断H2S2的结构式;
C.质量数=质子数+中子数,元素符号的左上角为质量数、左下角为质子数;
D.氯离子为阴离子,其电子式中需要标出最外层电子.
解答 解:A.Na2O2为离子化合物,阴阳离子需要标出所带电荷,过氧根离子还需要标出最外层电子,过氧化钠在的电子式为: ,故A错误;
,故A错误;
B.H2S2中含有两个S-S键和1个S-S键,其结构式为:H-S-S-H,故B正确;
C.原子核内有8个中子的碳原子的质量数为14,该碳原子的正确表示方法为:614C,故C错误;
D.氯化铵为离子化合物,铵根离子和氯离子都需要标出所带电荷及最外层电子,氯化铵正确的电子式为: ,故D错误;
,故D错误;
故选B.
点评 本题考查了常见化学用语的表示方法,题目难度中等,涉及电子式、元素符号、结构式等知识,明确常见化学用语的书写原则为解答关键,试题培养了学生的规范答题能力.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案
相关题目
13.向 Cr2 (SO4)3 的水溶液中加入NaOH溶液,当pH=4.6时开始出现Cr(OH)3沉淀,随着pH的升高,沉淀增多,当pH≥13时,沉淀消失,出现亚铬酸根离子(CrO2-),其平衡关系:
Cr3++3OH-?Cr(OH)3?CrO2-+H++H2O
(紫色) (灰绿色) (亮绿色)
向50mL 0.05mol•L-1的Cr2(SO4)3 溶液中加入等体积1.0mol•L-1的 NaOH溶液,充分反应后,溶液中可观察到的现象为( )
Cr3++3OH-?Cr(OH)3?CrO2-+H++H2O
(紫色) (灰绿色) (亮绿色)
向50mL 0.05mol•L-1的Cr2(SO4)3 溶液中加入等体积1.0mol•L-1的 NaOH溶液,充分反应后,溶液中可观察到的现象为( )
| A. | 溶液为紫色 | B. | 溶液为亮绿色 | ||
| C. | 溶液中有灰绿色沉淀 | D. | 无法判断 |
20.下列物质分别与NaOH的醇溶液共热后,能发生消去反应,且生成的有机物不存在同分异构体的是( )
| A. |  | B. |  | C. | CH3Cl | D. |  |
10.下列有机物系统命名正确的是( )
| A. |  | B. |  | C. |  | D. |  |
17.表为元素周期表的一部分.
(1)表中元素F的非金属性最强;元素K的金属性最强;元素Br的单质室温下呈液态(填写元素符号);
(2)表中元素⑤的原子结构示意图是 ;
;
(3)表中元素⑥⑨⑩氢化物的稳定性顺序为HF>HCl>H2S(填化学式);
(4)表中元素⑨和⑩最高价氧化物对应水化物的酸性:HClO4>H2SO4(填化学式);
(5)表中元素②的最高价氧化物属于两性氧化物(选填“酸性氧化物、两性氧化物、碱性氧化物”).
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 一 | ① | ||||||
| 二 | ③ | ④ | ⑤ | ⑥ | |||
| 三 | ⑦ | ⑧ | ② | ⑨ | ⑩ | ||
| 四 | ⑪ | ⑫ | |||||
(2)表中元素⑤的原子结构示意图是
 ;
;(3)表中元素⑥⑨⑩氢化物的稳定性顺序为HF>HCl>H2S(填化学式);
(4)表中元素⑨和⑩最高价氧化物对应水化物的酸性:HClO4>H2SO4(填化学式);
(5)表中元素②的最高价氧化物属于两性氧化物(选填“酸性氧化物、两性氧化物、碱性氧化物”).
14.下列物质常温下能与溴水发生取代反应的是( )
| A. | 苯酚 | B. | 苯乙烯( ) ) | C. | 苯 | D. | 苯甲醇(  ) ) |
15.工业生产水煤气的反应为:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.4kJ•mol-1,下列判断正确的是( )
| A. | 反应物能量总和大于生成物能量总和 | |
| B. | CO(g)+H2(g)?C(s)+H2O(l)△H=-131.4kJ•mol-1 | |
| C. | 水煤气反应中生成1molH2(g)吸收131.4 kJ热量 | |
| D. | 水煤气反应中生成1L CO(g)吸收131.4 kJ热量 |