题目内容
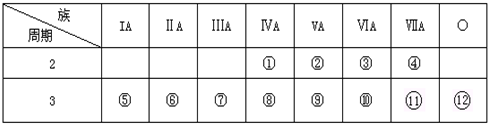
11.L、M、R、T、W是原子序数依次增大的短周期主族元素,M、T在周期表中的相对位置如表:L与R原子的最外层电子数相同,R的单质是一种常见的半导体材料.请回答下列问题:| M | |
| T |
 ,元素W在周期表中位于第三周期第ⅦA族,M单质分子的电子式为
,元素W在周期表中位于第三周期第ⅦA族,M单质分子的电子式为 .
.(2)R是组成玻璃的元素之一,不能用带磨口玻璃塞的试剂瓶放氢氧化钠溶液的原因是(用化学方程式表示)SiO2+2NaOH═Na2SiO3+H2O.
(3)下列有关相应元素非金属性强弱比较的说法,正确的是(填序号)acd.
a.M的气态氢化物比R的气态氢化物稳定,则非金属性M强于R
b.高温下L的单质能从R的最高价氧化物中置换出R,则非金属性L强于R
c.W的核电荷数比T多,原子半径比T小,得电子能力强,则非金属性W强于T
d.同温、同物质的量浓度的Na2LO3和Na2TO4溶液pH:Na2LO3>Na2TO4,则非金属性T强于L
(4)工业上可用二氧化硅、氯气和焦炭在高温条件下制备RW4,该反应中除RW4外的另一种产物可以用于工业冶炼铁.制备RW4反应的化学方程式为2Cl2+SiO2+2C$\frac{\underline{\;高温\;}}{\;}$SiCl4+2CO.
分析 L、M、R、T、W是原子序数依次增大的短周期主族元素,R的单质是一种常见的半导体材料,则R为Si,L与R原子的最外层电子数相同,二者同主族,则L为C元素,结合M、T在周期表中的相对位置,可知M处于第二周期,T处于第三周期,M只能处于ⅤA族,T、W分别处于ⅥA、ⅦA族,可推知M为N元素、T为S元素、W为Cl,据此解答.
解答 解:L、M、R、T、W是原子序数依次增大的短周期主族元素,R的单质是一种常见的半导体材料,则R为Si,L与R原子的最外层电子数相同,二者同主族,则L为C元素,结合M、T在周期表中的相对位置,可知M处于第二周期,T处于第三周期,M只能处于ⅤA族,T、W分别处于ⅥA、ⅦA族,可推知M为N元素、T为S元素、W为Cl.
(1)S原子的结构示意图为 ,元素Cl在周期表中位于第三周期第ⅦA族,M单质分子为N2,分子中N原子之间形成3对共用电子对,电子式为
,元素Cl在周期表中位于第三周期第ⅦA族,M单质分子为N2,分子中N原子之间形成3对共用电子对,电子式为  ,
,
故答案为: ;第三周期第ⅦA族;
;第三周期第ⅦA族; ;
;
(2)二氧化硅与氢氧化钠反应生成硅酸钠,硅酸钠是无机矿物胶,使磨口玻璃塞粘住,不能用带磨口玻璃塞的试剂瓶盛放,反应方程式为SiO2+2NaOH═Na2SiO3+H2O,
故答案为:SiO2+2NaOH═Na2SiO3+H2O;
(3)a.M的气态氢化物比R的气态氢化物稳定,非金属性越强氢化物越稳定,则非金属性M强于R,故a正确;
b.高温下,L的单质能从R的最高价氧化物中置换出R,高温条件改变了物质的性质,不能说明非金属性L强于R,故b错误;
c.W的核电荷数比T多,原子半径比T小,W原子核对核外电子吸引越强,得电子能力强,则非金属性W强于T,故c正确;
d.同温同物质的量浓度的Na2CO3和Na2SO4溶液pH:Na2CO3>Na2SO4,说明酸性碳酸弱于硫酸,故则非金属性S强于C,故d正确,
故答案为:acd;
(4)工业上可用二氧化硅、氯气和焦炭在高温条件下制备SiCl4,且该反应中除SiCl4外的另一种产物可以用于工业冶炼铁,该产物为CO,制备SiCl4反应的化学方程式为2Cl2+SiO2+2C$\frac{\underline{\;高温\;}}{\;}$SiCl4+2CO,
故答案为:2Cl2+SiO2+2C$\frac{\underline{\;高温\;}}{\;}$SiCl4+2CO.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,(3)中b选项为易错点,学生容易根据置换反应判断,忽略外界条件对物质性质的影响,难度中等.

 ,根据官能团的不同可分为( )
,根据官能团的不同可分为( )| A. | 7类 | B. | 6类 | C. | 5类 | D. | 4类 |
| A. | 0.1mol/L的硫酸 | B. | 0.1mol/L的硝酸 | ||
| C. | 0.1mol/L的盐酸 | D. | 0.1mol/L的醋酸(CH3COOH) |
 溴苯,无色油状液体,具有苯的气味.不溶于水,能溶于有机溶剂.实验室制取溴苯时先将铁粉和苯加入反应器,在搅拌下慢慢加入溴苯,置于70-80℃水浴中反应1h,所得粗品用水及5%氢氧化钠溶液洗涤,静置分层,蒸馏;干燥;过滤,最后经常压分馏,取156-157℃馏分而得成品.制取装置如图所示,请依据下列信息回答问题.
溴苯,无色油状液体,具有苯的气味.不溶于水,能溶于有机溶剂.实验室制取溴苯时先将铁粉和苯加入反应器,在搅拌下慢慢加入溴苯,置于70-80℃水浴中反应1h,所得粗品用水及5%氢氧化钠溶液洗涤,静置分层,蒸馏;干燥;过滤,最后经常压分馏,取156-157℃馏分而得成品.制取装置如图所示,请依据下列信息回答问题.| 物质 | 溴 | 苯 | 溴苯 |
| 沸点 | 58.5℃ | 80.1℃ | 156.2℃ |
 .
.(2)仪器a的名称为三颈烧瓶,仪器c的作用是冷凝回流、导气.
(3)反应置于70-80℃水浴中而非直接加热的目的是使反应受热均匀,尽可能减少反应的挥发,防止生成的溴苯挥发.
(4)水洗后用5%氢氧化钠溶液洗涤的目的Br2+2OH-=Br-+BrO-+H2O(用离子方程式表示).
| A. |  | B. |  | C. | CH3Cl | D. |  |
| A. | 0.1(b-4a) mol•L-1 | B. | 0.1(b-2a) mol•L-1 | C. | 10(b-4a) mol•L-1 | D. | 10(b-2a) mol•L-1 |