题目内容
回答下列问题:
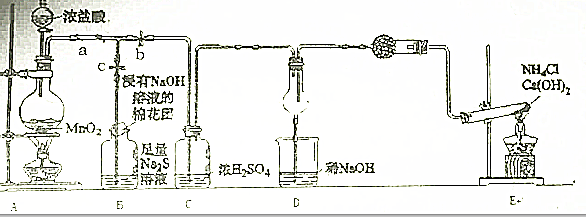
(1)检查气体发生装置A的气密性的操作是
(2)写出A中反应的离子方程式:
(3)B中出现的黄色浑浊现象,产生此现象的离子方程式.
(4)试从原子结构角度解释氯的氧化性大于硫原因 .

(1)检查气体发生装置A的气密性的操作是
(2)写出A中反应的离子方程式:
(3)B中出现的黄色浑浊现象,产生此现象的离子方程式.
(4)试从原子结构角度解释氯的氧化性大于硫原因
考点:氯气的实验室制法
专题:实验题
分析:(1)检验装置气密性的方法一般用微热的方法,根据冒出的气泡和回流的水柱来判断;
(2)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气和水;
(3)氯气具有强的氧化性,能够氧化硫离子;
(4)氧化性强表示得电子能力强,氯原子最外层电子数比硫原子更接近于8个电子的稳定结构,因此氯原子的得电子能力强;
(2)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气和水;
(3)氯气具有强的氧化性,能够氧化硫离子;
(4)氧化性强表示得电子能力强,氯原子最外层电子数比硫原子更接近于8个电子的稳定结构,因此氯原子的得电子能力强;
解答:
解:(1)检查气体发生装置A的气密性的操作是:在玻璃管口处接一段乳胶管,乳胶管头上连一段玻璃管,并将管口没入水中,用酒精灯火焰微热烧瓶底部,如果能够观察到没入水中的玻璃管口有气体逸出,停止加热后,玻璃管内有水柱上升,且较长时间水柱不回落,则标明该套装置气密性良好;
故答案为:在玻璃管口处接一段乳胶管,乳胶管头上连一段玻璃管,并将管口没入水中,用酒精灯火焰微热烧瓶底部,如果能够观察到没入水中的玻璃管口有气体逸出,停止加热后,玻璃管内有水柱上升,且较长时间水柱不回落,则标明该套装置气密性良好;
(2)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气和水,离子方程式为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O;
故答案为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O;
(3)氯气具有强的氧化性,能够氧化硫离子,离子方程式为:S2-+Cl2=S↓+2Cl-;
故答案为:S2-+Cl2=S↓+2Cl-;
(4)氯原子最外层有7个电子,硫原子最外层有6个电子,最外层电子多(不为8)得电子能力就强,得电子能力强则氧化性强,
故答案为:氯原子最外层电子数比硫原子多一个,Cl得电子能力强,故Cl2氧化性大于S;
故答案为:在玻璃管口处接一段乳胶管,乳胶管头上连一段玻璃管,并将管口没入水中,用酒精灯火焰微热烧瓶底部,如果能够观察到没入水中的玻璃管口有气体逸出,停止加热后,玻璃管内有水柱上升,且较长时间水柱不回落,则标明该套装置气密性良好;
(2)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气和水,离子方程式为:MnO2+4H++2Cl-
| ||
故答案为:MnO2+4H++2Cl-
| ||
(3)氯气具有强的氧化性,能够氧化硫离子,离子方程式为:S2-+Cl2=S↓+2Cl-;
故答案为:S2-+Cl2=S↓+2Cl-;
(4)氯原子最外层有7个电子,硫原子最外层有6个电子,最外层电子多(不为8)得电子能力就强,得电子能力强则氧化性强,
故答案为:氯原子最外层电子数比硫原子多一个,Cl得电子能力强,故Cl2氧化性大于S;
点评:本题考查了氯气的制备和性质检验,明确制备原理和氯气性质是解题关键,题目难度不大.

练习册系列答案
相关题目
下列实验操作要用到玻璃棒的是( )
①溶解 ②过滤 ③蒸发 ④向容量瓶转移液体 ⑤蒸馏 ⑥分液.
①溶解 ②过滤 ③蒸发 ④向容量瓶转移液体 ⑤蒸馏 ⑥分液.
| A、全部 | B、②③④⑤ |
| C、①②③④ | D、①③④⑤⑥ |
某烷烃一个分子里含有9个碳原子,其一氯代物只有两种,这种烷烃的名称是( )
| A、正壬烷 |
| B、2,6二甲基庚烷 |
| C、2,3,4三甲基己烷 |
| D、2,2,4,4四甲基戊烷 |
已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系符合如图.则甲和X不可能是( )

| A、甲:Fe、X:Cl2 |
| B、甲:SO2、X:NaOH溶液 |
| C、甲:C、X:O2 |
| D、甲:AlCl3溶液、X:NaOH溶液 |
反应N2(g)+O2(g)?2NO(g)在恒容密闭容器中进行,达到平衡后,充入N2,下列说法正确的是( )
| A、平衡向逆反应方向移动,N2和O2的转化率都减小 |
| B、平衡向正反应方向移动,N2和O2的转化率都增大 |
| C、压强增大平衡不移动,N2的转化率不变 |
| D、平衡向正反应方向移动,N2的转化率减小,O2的转化率增大 |
可逆反应:3R(气)?3M(?)十N(?) ( 吸热反应 ),随着温度的升高,气体平均相对分子质量有变小的趋势.则下列判断中正确的是( )
| A、M和N可能都是固体 |
| B、若N为固体.则M一定是气体 |
| C、M和N一定都是气体 |
| D、若M为固体.则N一定是气体 |
已知氢气在氯气中燃烧时产生苍白色火焰,在反应过程中,破坏1mol氢气的化学键消耗的能量为Q1kJ,破坏1mol氯气的化学键消耗的能量为Q2kJ,形成1mol氯化氢中的化学键释放的能量为Q3kJ,下列关系式正确的是( )
| A、Q1+Q 3 |
| B、Q1+Q2>2Q3 |
| C、Q1+Q2<Q3 |
| D、Q1+Q2<2Q3 |
将标准状况下的a升氨气溶于1000克水中,得到的氨水的密度为b克/毫升,则该氨水的物质的量的浓度是( )
A、
| ||
B、
| ||
C、
| ||
D、
|