题目内容
18.二氧化氯气体有毒,常应用在果蔬保鲜等方面.用NaClO3与CH3OH(沸点64.7℃)在催化剂、60℃时,发生反应得到ClO2,实验装置如图(已知ClO2的稳定性较差,用稳定剂吸收ClO2,使用时加酸释放出ClO2).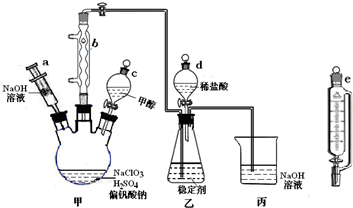
完成下列填空:
(1)仪器b的名称为球形冷凝管,其作用是冷凝回流甲醇.
(2)反应中甲醇被氧化为甲酸(HCOOH),写出制备ClO2的化学方程式4NaClO3+CH3OH+2H2SO4$\frac{\underline{\;催化剂\;}}{△}$4ClO2↑+HCOOH+2Na2SO4+3H2O.
(3)甲装置中采取的加热方式是水浴加热;如果滴加甲醇的速度过快,可能造成的后果反应速率过快,反应生成的ClO2来不及被稳定剂吸收.
(4)某同学建议将上述装置中的分液漏斗c改用恒压漏斗e,你认为他的理由是有利于液体顺利流下,减少甲醇的挥发.
(5)实验结束后,先用仪器a注入一定量的NaOH,过一段时间后再拆卸仪器,其目的是使反应停止,并吸收ClO2.
(6)如表是两种稳定剂加酸后释放ClO2的浓度随时间的变化数据,若将其用于樱桃保鲜,你认为效果较好的稳定剂是2,原因是稳定剂2释放ClO2的浓度稳定,保鲜时间更长.
| 时间 稳定剂 | 0天 | 2天 | 4天 | 6天 | 8天 | 10天 | 12天 | 14天 | 16天 |
| 稳定剂1浓度 | 80 | 150 | 80 | 20 | 10 | 5 | 0 | 0 | 0 |
| 稳定剂2浓度 | 40 | 52 | 52 | 52 | 52 | 50 | 48 | 47 | 20 |
在锥形瓶中加入足量的KI溶液,再加入5mL稀硫酸;取15mL保鲜剂于锥形瓶中,ClO2与KI反应的离子方程式为:2ClO2+10I-+8H+═2Cl-+5I2+4H2O;用0.100mol•L-1 Na2S2O3标准溶液滴定碘单质(I2+2S2O32-═2I-+S4O62-),达到滴定终点时用去18.00mL Na2S2O3标准溶液.测得该保鲜剂中ClO2的含量为1.62 g•L-1.
分析 (1)根据仪器特征,可知仪器b是球形冷凝管,甲醇易挥发性,冷凝回流甲醇;
(2)甲醇被氧化为甲酸(HCOOH),NaClO3还原生成ClO2,在硫酸条件下,还生成硫酸钠;
(3)甲装置控制反应温度60℃,采取水浴加热;加甲醇的速度过快,反应速率过快,反应生成的ClO2来不及被稳定剂吸收;
(4)有利于液体顺利流下,减少甲醇的挥发;
(5)可以中和酸,使反应停止,并吸收ClO2;
(6)稳定剂2释放ClO2的浓度稳定,保鲜效果更好;
(7)根据关系式2ClO2~5I2~10S2O32-计算.
解答 解:(1)根据仪器特征,可知仪器b是球形冷凝管,甲醇易挥发性,冷凝回流甲醇,
故答案为:球形冷凝管;冷凝回流甲醇;
(2)甲醇被氧化为甲酸(HCOOH),NaClO3还原生成ClO2,在硫酸条件下,还生成硫酸钠,反应方程式为:4NaClO3+CH3OH+2H2SO4$\frac{\underline{\;催化剂\;}}{△}$4ClO2↑+HCOOH+2Na2SO4+3H2O,
故答案为:4NaClO3+CH3OH+2H2SO4$\frac{\underline{\;催化剂\;}}{△}$4ClO2↑+HCOOH+2Na2SO4+3H2O;
(3)甲装置控制反应温度60℃,低于水的沸点,采取水浴加热,受热均匀,便于控制温度;加甲醇的速度过快,反应速率过快,反应生成的ClO2来不及被稳定剂吸收,
故答案为:水浴加热;反应速率过快,反应生成的ClO2来不及被稳定剂吸收;
(4)分液漏斗添加乙醇,需要将分液漏斗活塞打开,便于甲醇液体顺利流下,但会导致甲醇的挥发,改用恒压漏斗有利于液体顺利流下,减少甲醇的挥发,
故答案为:有利于液体顺利流下,减少甲醇的挥发;
(5)加入氢氧化钠可以中和酸,使反应停止,并吸收ClO2,
故答案为:使反应停止,并吸收ClO2;
(6)稳定剂2释放ClO2的浓度稳定,保鲜时间更长,保鲜效果更好,
故答案为:2;稳定剂2释放ClO2的浓度稳定,保鲜时间更长;
(7)设保鲜剂中ClO2的含量为xg•L-1,则:
2ClO2~5I2~10S2O32-
135g 10mol
0.015L×xg/L 0.018L×0.1mol/L
所以135g:0.015L×xg/L=10mol:0.018L×0.1mol/L
解得x=1.62
故答案为:1.62.
点评 本题考查物质准备实验,涉及化学仪器识别与使用、陌生方程式书写、实验基本操作、对操作的分析评价、物质含量测定等,较好地考查学生实验能力、分析解决问题的能力.

| A. | N2→NO2→HNO3 | B. | Fe→FeCl3→FeCl2 | ||
| C. | S→SO3→Na2SO4 | D. | Al2O3→Al(OH)3→NaAlO2 |
| A. | 已知Fe+S$\frac{\underline{\;\;△\;\;}}{\;}$FeS,则Cu+S$\frac{\underline{\;\;△\;\;}}{\;}$CuS | |
| B. | Fe能与CuSO4溶液反应,可知Al与CuSO4溶液也能反应 | |
| C. | CaS03与稀盐酸反应生成SO2,可知CaSO3与稀硝酸反应也生成SO2 | |
| D. | 已知H2O2能氧化I一,可知H2O2也能氧化Cl- |
| A. | 氧化铁可用作红色油漆和涂料 | B. | 硅胶可作干燥剂 | ||
| C. | 纯碱可作糕点的发酵粉 | D. | 过氧化钠作呼吸面具供氧剂 |
| A. | 用(NH4)2Fe(SO4)2 溶液与过量NaOH反应制Fe(OH)2:Fe2++2OH-=Fe(OH)2↓ | |
| B. | 用稀氢碘酸溶液除去铁制品表面的铁锈:Fe2O3+6H+=2Fe3++3H2O | |
| C. | 向小苏打溶液中加入少量Ca(OH)2溶液反应:Ca2++2OH-+2HCO3-=CaCO3↓+2H2O+CO32- | |
| D. | 向NaClO溶液中滴入少量FeSO4溶液,反应的离子方程式为:2Fe2++ClO-+2H+═Cl-+2Fe3++H2O |
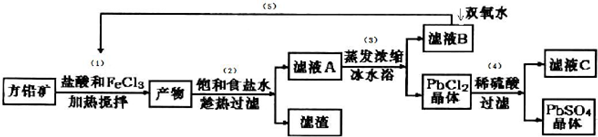
已知:①Ksp(PbSO4)=1.08×10-8,Ksp(PbCl2)=1.6×l0-5.
②PbCl2(s)+2C1-(aq)?PbCl42-(aq)△H>0
③Fe3+、Pb2+以氢氧化物形式开始沉淀时的PH值分别为1.9和7.
(I )流程中加入盐酸可以控制溶液的pH<1.9,主要目的是抑制Fe3+的水解.反应过程中可观察到淡黄色沉淀,则步骤(1)对应的主要反应的离子方程式为2Fe3++PbS=PbCl2+S+2Fe2+.
(II) 步骤(2)所得的滤液A 蒸发浓缩后再用冰水浴的目的是用冰水浴使PbCl2(s)+2Cl-(aq)?PbCl4-△H>0逆向移动,使PbCl4-转化PbCl2析出(请用平衡移动原理解释)
(III )上述流程中可循环利用的物质有FeCl3、HCl.
(IV)炼铅和用铅都会使水体因重金属铅的含量增大而造成严重污染.水溶液中铅的存在形态主要有
Pb2+、Pb(OH)+、Pb(OH)2、Pb(OH)3-、Pb(OH)42-.各形态的铅浓度分数α与溶液pH 变化的关系如图所示:

①探究Pb2+的性质:向含Pb2+的溶液中逐滴滴加NaOH,溶液变浑浊,继续滴加NaOH溶液又变澄清;pH≥13时,溶液中发生的主要反应的离子方程式为Pb(OH)3-+HO-=Pb(OH)42-..
②除去溶液中的Pb2+:科研小组用一种新型试剂可去除水中的痕量铅和其他杂质离子,实验结果记录如下:
| 离子 | Pb2+ | Ca2+ | Fe3+ | Mn2+ |
| 处理前浓度/(mg•L-1) | 0.100 | 29.8 | 0.12 | 0.087 |
| 处理后浓度/(mg•L-1) | 0.004 | 22.6 | 0.04 | 0.053 |
Ⅱ.若新型试剂(DH)在脱铅过程中主要发生的反应为:2DH(s)+Pb2+?D2Pb(s)+2H+,则脱铅时最合适的pH约为B.
A.4 B.6 C. 10 D. 12.
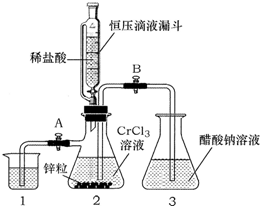 酣酸亚铬晶体是一种氧气吸收剂,化学式为[Cr(CH3COO)2]2•2H2O,不溶于冷水,易溶于盐酸.由于Cr2+易被氧气氧化,制备醋酸亚铬时,需在封闭体系中用锌作还原剂,先将Cr3+还原为Cr2+,再与醋酸钠溶液作用制得,其总反应为:
酣酸亚铬晶体是一种氧气吸收剂,化学式为[Cr(CH3COO)2]2•2H2O,不溶于冷水,易溶于盐酸.由于Cr2+易被氧气氧化,制备醋酸亚铬时,需在封闭体系中用锌作还原剂,先将Cr3+还原为Cr2+,再与醋酸钠溶液作用制得,其总反应为:
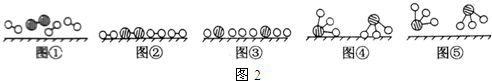
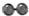 、
、 、
、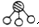 分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是N2、H2被吸附在催化剂表面、在催化剂表面N2、H2中的化学键断裂.
分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是N2、H2被吸附在催化剂表面、在催化剂表面N2、H2中的化学键断裂.