题目内容
19. 短周期元素Q、R、T、W在元素周期表中的位置如右图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
短周期元素Q、R、T、W在元素周期表中的位置如右图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:(1)T的元素名称为Al.
(2)元素的非金属性为:Q< R(填“>”或“<”).
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为S+2H2SO4(浓)$\frac{\underline{\;加热\;}}{\;}$3SO2↑+2H2O.
(4)原子序数比R多1的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
(5)R有多种氧化物,其中甲的相对分子质量最小,甲气体与氧气反应的化学方程式是2NO+O2=2NO2.
分析 (1)根据短周期元素Q、R、T、W在元素周期表中的位置知,Q和R位于第二周期、T和W位于第三周期,T所处的周期序数与主族序数相等,则T是Al元素,可推知Q是C元素、R是N元素、W是S元素;
(2)同周期自左而右非金属性减弱;
(3)硫与浓硫酸再加热条件下反应生成二氧化硫与水;
(4)原子序数比R多1的元素为氧,氧元素的一种氢化物能分解为它的另一种氢化物,应是过氧化氢分解为水与氧气;
(5)氮元素的氧化物中相对分子质量最小甲为NO,NO与氧气反应生成二氧化氮.
解答 解:(1)根据短周期元素Q、R、T、W在元素周期表中的位置知,Q和R位于第二周期、T和W位于第三周期,T所处的周期序数与主族序数相等,则T是Al元素,可推知Q是C元素、R是N元素、W是S元素,
故答案为:Al;
(2)同周期自左而右非金属性减弱,故非金属性C<N,
故答案为:<;
(3)硫与浓硫酸再加热条件下反应生成二氧化硫与水,反应方程式为:S+2H2SO4(浓)$\frac{\underline{\;加热\;}}{\;}$3SO2↑+2H2O,
故答案为:S+2H2SO4(浓)$\frac{\underline{\;加热\;}}{\;}$3SO2↑+2H2O;
(4)原子序数比R多1的元素为氧,氧元素的一种氢化物能分解为它的另一种氢化物,应是过氧化氢分解为水与氧气,反应方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,
故答案为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
(5)氮元素的氧化物中相对分子质量最小甲为NO,NO与氧气反应生成二氧化氮,反应方程式为:2NO+O2=2NO2,
故答案为:2NO+O2=2NO2.
点评 本题考查原子结构与元素周期表知识,明确元素种类是解题关键,侧重对元素周期律与元素化合物性质的考查,难度不大.

| A. | 1molCu和足量热浓硫酸反应可生成22.4LSO2气体 | |
| B. | 2L0.5mol/L亚硫酸溶液中含有的H+离子数为2NA | |
| C. | 过氧化钠与水反应时,生成0.2mol氧气转移的电子数为0.2NA | |
| D. | 3mol单质Fe完全转变为Fe3O4,失去8NA个电子 |
| A. | 第n(n>1)周期共含有(8-n)种非金属元素 | |
| B. | 同一周期,第ⅡA族与第ⅢA族元素原子序数的差值可以为1、10或25 | |
| C. | 第ⅠA族习惯上又称为碱金属元素 | |
| D. | 有七个主族,七个副族,一个第Ⅷ族,一个零族,共16个纵行 |
| A. | 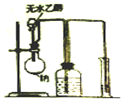 测量钠与乙醇反应生成H2的体积 | B. |  制取乙烯 | ||
| C. | 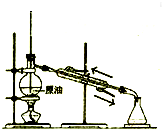 蒸馏石油 | D. | 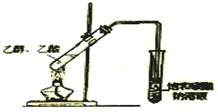 制取乙酸乙酯 |
| A. | Na放入水中,产生气体:2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | FeCl3溶液刻蚀印刷线路板:2Fe3++Cu═2Fe2++Cu2+ | |
| C. | 铜溶于稀HNO3溶液:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| D. | AlCl3溶液中加入过量氨水:Al3++4OH-═AlO2-+2H2O |
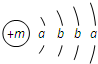 ,X的阳离子与Y的阴离子的电子层结构相同.元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子.
,X的阳离子与Y的阴离子的电子层结构相同.元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子.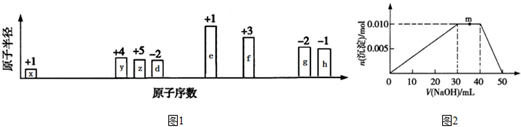
 (或
(或
 等);
等);