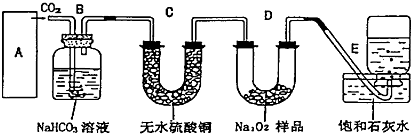
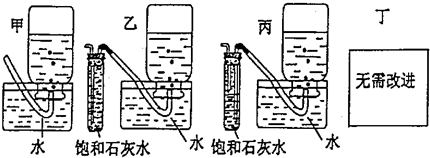
题目内容
11.有关化学反应的说法中,正确的是( )| A. | 自发反应都是放热反应 | B. | 自发反应都是熵增加的反应 | ||
| C. | 自发反应都是△G<0的反应 | D. | 自发反应都是△G>0的反应 |
分析 A、放热反应有利于反应的自发进行;
B.熵增反应有利于反应的自发进行;
C.△G<0反应自发进行即△H-T△S<0;
D.△G>0反应非自发进行即△H-T△S>0;
解答 解:A、放热反应有利于反应的自发进行,但是并不是自发反应都是放热反应,有的吸热反应也能自发进行,故A错误;
B.熵增反应有利于反应的自发进行,但是自发反应不一定是熵增大的反应,故C错误;
C.反应自发进行,△G<0即△H-T△S<0,故C正确;
D.△G>0即△H-T△S>0,反应非自发进行,故D错误;
故选C.
点评 本题涉及化学反应能否自发进行的判断知识,可以根据所学课本知识来回答,难度不大.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
1.向平衡CH3COOH+HOCH2CH3$\frac{\underline{\;浓H_{2}SO_{4}\;}}{△}$CH3COOCH2CH3+H2O中加入CH3CH218OH,则平衡时,含有18O的物质的种类是( )
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
19.反应N2(g)+3H2(g)?2NH3(g)在密闭容器中进行.下列关于该反应的说法正确的是( )
| A. | 加热能减慢反应速率 | |
| B. | 增大压强能加快反应速率 | |
| C. | 反应达到平衡时,v(正反应)=v(逆反应)=0 | |
| D. | 反应达到平衡时,N2转化率为100% |
6.原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的 一种1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子s原子轨道与p原子轨道电子数相等;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子.
(1)Y原子核外共有7种不同运动状态的电子,T原子有7种不同原子轨道的电子.
(2)X、Y、Z的第一电离能由小到大的顺序为C<O<N(用元素符号表示).
(3)Z与R能形成化合物甲,1mol甲中含4mol化学键,甲与氢氟酸反应,生成物的分子空间构型分别为正四面体形、V形;
(4)G、Q、R氟化物的熔点如下表,造成熔点差异的原因为NaF与MgF2为离子晶体,SiF4为分子晶体,故SiF4的熔点低;Mg2+的半径比Na+的半径小、电荷数高,晶格能MgF2>NaF,故MgF2的熔点比NaF高;
(5)向T的硫酸盐溶液中逐滴加入Y的氢化物的水溶液至过量,反应的离子方程式为Cu2++2 NH3•H2O=Cu(OH)2↓+2NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-.
(1)Y原子核外共有7种不同运动状态的电子,T原子有7种不同原子轨道的电子.
(2)X、Y、Z的第一电离能由小到大的顺序为C<O<N(用元素符号表示).
(3)Z与R能形成化合物甲,1mol甲中含4mol化学键,甲与氢氟酸反应,生成物的分子空间构型分别为正四面体形、V形;
(4)G、Q、R氟化物的熔点如下表,造成熔点差异的原因为NaF与MgF2为离子晶体,SiF4为分子晶体,故SiF4的熔点低;Mg2+的半径比Na+的半径小、电荷数高,晶格能MgF2>NaF,故MgF2的熔点比NaF高;
| 氟化物 | G的氟化物 | Q的氟化物 | R的氟化物 |
| 熔点/K | 993 | 1539 | 183 |
16.下列叙述正确的是( )
| A. | CH4和CH3CH2CH2CH3分子组成相差2个-CH2-,因此二者是同系物 | |
| B. | 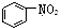 是芳香烃 是芳香烃 | |
| C. | 醇类的官能团是-CHO | |
| D. | 凡是含有碳元素的化合物都属于有机物 |
 ;另一种没有支链且能被氧化成醛,写出它与乙酸发生酯化反应的方程式CH3COOH+CH3CH2CH2CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH2CH2CH3+H2O.
;另一种没有支链且能被氧化成醛,写出它与乙酸发生酯化反应的方程式CH3COOH+CH3CH2CH2CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH2CH2CH3+H2O.