题目内容
某溶液,只可能含有以下离子中的若干种:H+、NH4+、K+、Mg2+、NO2-、CO32-、NO3-,现取两份100mL溶液进行如下实验:
①第一份加足量AgNO3溶液后,有5.84g白色沉淀产生,沉淀中加入足量稀盐酸充分反应,有棕色气体产生,沉淀颜色不变,但是质量减少0.1g;
②将产生的气体全部通入过量的澄清石灰水,又得到白色沉淀1.0g,该沉淀能溶于稀盐酸产生无色气体;
③第二份加入过量浓NaOH溶液,加热使产生的气体全部放出,用50mL0.5mol?L-1的硫酸溶液恰好完全吸收,酸也不剩余.
根据上述实验,以下推测不正确的是( )
①第一份加足量AgNO3溶液后,有5.84g白色沉淀产生,沉淀中加入足量稀盐酸充分反应,有棕色气体产生,沉淀颜色不变,但是质量减少0.1g;
②将产生的气体全部通入过量的澄清石灰水,又得到白色沉淀1.0g,该沉淀能溶于稀盐酸产生无色气体;
③第二份加入过量浓NaOH溶液,加热使产生的气体全部放出,用50mL0.5mol?L-1的硫酸溶液恰好完全吸收,酸也不剩余.
根据上述实验,以下推测不正确的是( )
| A、原溶液一定不存在较大浓度的H+、Mg2+ |
| B、原溶液确定含NH4+、NO2-、CO32-,且物质的量之比为5:2:1 |
| C、不能确定原溶液是否含有K+、NO3- |
| D、实验中产生的棕色气体遇空气颜色会加深 |
考点:常见阳离子的检验,常见阴离子的检验
专题:离子反应专题
分析:①第一份加足量AgNO3溶液后,有5.84g白色沉淀产生,沉淀中加入足量稀盐酸充分反应,有棕色气体产生,沉淀颜色不变,但是质量减少0.1g,这说明该白色沉淀中一定含有亚硝酸银,亚硝酸银与盐酸反应生成氯化银与亚硝酸,亚硝酸不稳定分解生成NO、NO2和水;所以原溶液中一定含有NO2-,则H+一定不能大量共存;
②将产生的气体全部通入过量的澄清石灰水,又得到白色沉淀1.0g,该沉淀能溶于稀盐酸产生无色气体,则该白色沉淀应该是碳酸钙,物质的量是0.01mol,所以气体中含有CO2,这说明反应①中生成的白色沉淀一定有碳酸银,则原溶液中一定含有CO32-,则Mg2+就一定不能大量共存;根据碳原子守恒,CO32-的物质的量是0.01mol,5.84g沉淀中亚硝酸银沉淀的质量为:5.84g-0.01mol×276g/mol=3.08g,因此亚硝酸银的物质的量为:
=0.02mol,则原溶液中NO2-的物质的量是0.02mol;
③第二份加入过量浓NaOH溶液,加热使产生的气体全部放出,该气体一定是氨气,因此原溶液中含有NH4+;用50mL0.5mol/L的硫酸溶液恰好完全吸收,酸也不剩余,硫酸的物质的量是:0.5mol/L×0.05L=0.025mol,则氨气的物质的量为:0.025mol×2=0.05mol,则原溶液中NH4+的物质的量是0.05mol,所以原溶液确定含NH4+、NO2-、CO32-,且物质的量之比为5:2:1,据此进行解答.
②将产生的气体全部通入过量的澄清石灰水,又得到白色沉淀1.0g,该沉淀能溶于稀盐酸产生无色气体,则该白色沉淀应该是碳酸钙,物质的量是0.01mol,所以气体中含有CO2,这说明反应①中生成的白色沉淀一定有碳酸银,则原溶液中一定含有CO32-,则Mg2+就一定不能大量共存;根据碳原子守恒,CO32-的物质的量是0.01mol,5.84g沉淀中亚硝酸银沉淀的质量为:5.84g-0.01mol×276g/mol=3.08g,因此亚硝酸银的物质的量为:
| 3.08g |
| 154g/mol |
③第二份加入过量浓NaOH溶液,加热使产生的气体全部放出,该气体一定是氨气,因此原溶液中含有NH4+;用50mL0.5mol/L的硫酸溶液恰好完全吸收,酸也不剩余,硫酸的物质的量是:0.5mol/L×0.05L=0.025mol,则氨气的物质的量为:0.025mol×2=0.05mol,则原溶液中NH4+的物质的量是0.05mol,所以原溶液确定含NH4+、NO2-、CO32-,且物质的量之比为5:2:1,据此进行解答.
解答:
解:根据①可知该白色沉淀中一定含有亚硝酸银,亚硝酸银与盐酸反应生成氯化银与亚硝酸,亚硝酸不稳定分解生成NO、NO2和水,所以原溶液中一定含有NO2-,则H+一定不能大量共存;
根据②可知该白色沉淀应该是碳酸钙,物质的量为:
=0.01mol,所以气体中含有CO2,这说明反应①中生成的白色沉淀一定有碳酸银,则原溶液中一定含有CO32-,则Mg2+就一定不能大量共存;根据碳原子守恒,CO32-的物质的量是0.01mol,5.84g沉淀中亚硝酸银沉淀的质量为:5.84g-0.01mol×276g/mol=3.08g,因此亚硝酸银的物质的量为:
=0.02mol,则原溶液中NO2-的物质的量是0.02mol;
根据③可知,该气体一定是氨气,因此原溶液中含有NH4+;用50mL0.5mol/L的硫酸溶液恰好完全吸收,酸也不剩余,硫酸的物质的量是0.5mol/L×0.05L=0.025mol,则氨气的物质的量为:0.025mol×2=0.05mol,则原溶液中NH4+的物质的量是0.05mol,
A.根据以上分析可知,原溶液中一定不存在较大浓度的H+、Mg2+,故A正确;
B.根据以上分析可知,原溶液一定存在NH4+、NO2-、CO32-,且物质的量之比为:0.05mol:0.02mol:0.01mol=5:2:1,故B正确;
C.根据电荷守恒可知,原溶液中一定还含有NO3-,但K+不能确定是否存在,故C错误;
D.实验中产生的棕色气体中含有NO,遇空气生成红棕色NO2,所以颜色会加深,故D正确;
故选C.
根据②可知该白色沉淀应该是碳酸钙,物质的量为:
| 1.0g |
| 100g/mol |
| 3.08g |
| 154g/mol |
根据③可知,该气体一定是氨气,因此原溶液中含有NH4+;用50mL0.5mol/L的硫酸溶液恰好完全吸收,酸也不剩余,硫酸的物质的量是0.5mol/L×0.05L=0.025mol,则氨气的物质的量为:0.025mol×2=0.05mol,则原溶液中NH4+的物质的量是0.05mol,
A.根据以上分析可知,原溶液中一定不存在较大浓度的H+、Mg2+,故A正确;
B.根据以上分析可知,原溶液一定存在NH4+、NO2-、CO32-,且物质的量之比为:0.05mol:0.02mol:0.01mol=5:2:1,故B正确;
C.根据电荷守恒可知,原溶液中一定还含有NO3-,但K+不能确定是否存在,故C错误;
D.实验中产生的棕色气体中含有NO,遇空气生成红棕色NO2,所以颜色会加深,故D正确;
故选C.
点评:本题考查考查离子共存、离子检验的有关判断,题目难度中等,注意掌握常见离子的性质及检验方法,根据电荷守恒判断硝酸根离子的存在情况为本题的难点.

练习册系列答案
相关题目
下列有机化合物中不存在异构体的是( )
| A、CH3CH2CH2CH3 |
| B、CH3OH |
| C、CH3CH2CHO |
| D、CH2=CHCH2CH3 |
下列指定反应的离子方程式正确的是( )
| A、Cu溶于稀HNO3:Cu+2H++NO3-═Cu2++NO2↑+H2O |
| B、(NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-═Fe(OH)2↓ |
| C、用CH3COOH溶解CaCO3:CaCO3+2H+═Ca2++H2O+CO2↑ |
| D、向NaAlO2溶液中通入过量CO2制Al(OH)3:CO2+AlO2-+2H2O═Al(OH)3↓+HCO3- |
 一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )
一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )| A、反应进行到6 s时,各物质的反应速率相等 |
| B、反应进行到1 s时,v (A)=v (C) |
| C、反应进行到6 s时,B的平均反应速率为0.1 mol/(L?s) |
| D、该反应的化学方程式为3B+4C?6A+2D |
四种短周期元素在周期表中的位置如图,其中只有M为金属元素.下列说法不正确的是( )
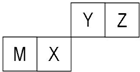

| A、M的离子半径小于Z的离子半径 |
| B、M和Y的最高价氧化物对应水化物之间能相互反应 |
| C、X的单质可以做光导纤维和半导体材料 |
| D、常温下,0.01mol/L的Y的气态氢化物的水溶液的pH=12 |
下列叙述错误的是( )
| A、汽车尾气中的NOx是造成光化学烟雾的唯一因素 |
| B、空气中SO2、NOx等是形成酸雨的重要原因 |
| C、冬天撒盐熔雪能造成土壤和水污染 |
| D、河流人海口处形成的三角洲是海水使河水泥沙胶体凝聚的结果 |
对如图两种化合物的结构或性质描述正确的是( )


| A、不是同分异构体 |
| B、分子中共平面的碳原子数相同 |
| C、均能与溴水反应 |
| D、可用红外光谱区分,但不能用核磁共振氢谱区分 |