题目内容
3.为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列五项操作:①过滤,②加过量NaOH溶液,③加适量盐酸,④加过量Na2CO3溶液,⑤加过量BaCl2溶液.正确的操作顺序是( )| A. | ④②⑤③① | B. | ⑤②④①③ | C. | ②⑤④③① | D. | ④①②⑤③ |
分析 除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,盐酸要放在最后,来除去过量的氢氧化钠和碳酸钠,要先加过量的氯化钡除去硫酸根离子,然后用碳酸钠去除过量的钡离子,所以④碳酸钠溶液必须放在⑤之后,以此来解答.
解答 解:要先除SO42-,然后再除Ca2+,Na2CO3可以除去过量的钡离子,如果加反了,过量的钡离子就没法除去,至于加NaOH除去Mg2+顺序不受限制,因为过量的氢氧化钠加盐酸就可以调节了,只要将三种离子除完了,过滤即可,最后加盐酸除去过量的氢氧根离子碳酸根离子,
所以操作顺序可以为:②⑤④①③或⑤②④①③或⑤④②①③,但不能为④②⑤①③,
故选B.
点评 本题考查粗盐的提纯,题目难度不大,明确加入试剂的作用及先后顺序为解答关键,注意掌握除杂原则,试题培养了学生的分析能力及化学实验能力.

练习册系列答案
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案
相关题目
12.汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3→K2O+5Na2O+16N2↑.若氧化产物比还原产物多1.75mol,则下列判断正确的是( )
| A. | 生成44.8LN2 | |
| B. | 有0.250molKNO3被氧化 | |
| C. | 转移电子的物质的量为1.25mol | |
| D. | 被氧化的N原子的物质的量为3.00mol |
14.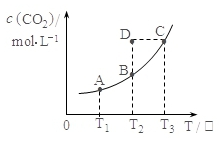 在密闭容器中存在下列平衡:CO(g)+H 2O(g)?CO2(g)+H 2(g);CO 2(g)的平衡物质的量浓度c(CO 2)与温度T的关系如图所示.下列说法错误的是( )
在密闭容器中存在下列平衡:CO(g)+H 2O(g)?CO2(g)+H 2(g);CO 2(g)的平衡物质的量浓度c(CO 2)与温度T的关系如图所示.下列说法错误的是( )
 在密闭容器中存在下列平衡:CO(g)+H 2O(g)?CO2(g)+H 2(g);CO 2(g)的平衡物质的量浓度c(CO 2)与温度T的关系如图所示.下列说法错误的是( )
在密闭容器中存在下列平衡:CO(g)+H 2O(g)?CO2(g)+H 2(g);CO 2(g)的平衡物质的量浓度c(CO 2)与温度T的关系如图所示.下列说法错误的是( )| A. | 平衡状态A与C相比,平衡状态A的c(CO)小 | |
| B. | 在T 2时,若反应处于状态D,则一定有V 正<V 逆 | |
| C. | 反应CO(g)+H 2O(g)?CO 2(g)+H 2(g) 的△H>0 | |
| D. | 若T 1、T 2时的平衡常数分别为K 1、K 2,则K 1<K 2 |
11.分离提纯是化学实验中常用的操作,下列不能用于分离提纯操作的仪器是( )
| A. | 普通漏斗 | B. | 长颈漏斗 | C. | 分液漏斗 | D. | 蒸发皿 |
8.在密闭容器中发生反应:aX(g)+bY(g)?cZ(g)+dW(g),反应达平衡后保持温度不变,将气体体积压缩到原来的一半,当再次达平衡时,W的浓度为原平衡时的1.7倍.下列叙述中不正确( )
| A. | 平衡向逆反应方向移动 | B. | a<c+d | ||
| C. | Z的体积分数增加 | D. | X的转化率下降 |
15.A、B、C、D、E为原子序数依次增大的短周期主族元素,A原子的最外层电子数为内层电子数的2倍,B原子的M电子层有1个电子,C的氢氧化物既能与强酸反应又能与强碱反应,D的最高正价和最低负价的代数和为4,E在同周期主族元素中原子半径最小.下列叙述错误的是( )
| A. | 元素C位于周期表中第三周期ⅢA族 | |
| B. | 电解熔融化合物CE3可制取单质C | |
| C. | D的最高价含氧酸的浓溶液与单质A共热时能生成三种氧化物 | |
| D. | 化合物B2D2中既含离子键又含非极性共价键 |
12.下列反应的离子方程式书写正确的是( )
| A. | 氢氧化铜溶于稀盐酸:2H++Cu(OH)2=Cu2++2H2O | |
| B. | 氢氧化钡溶液与稀硫酸溶液反应:Ba2++OH-+SO42-+H+=BaSO4↓+H2O | |
| C. | 锌粒与稀硝酸反应:Zn+2H+=Zn2++H2↑ | |
| D. | 向盐酸中加入适量氨水:H++OH-=H2O |
13.我国的四大发明之一黑火药,爆炸时的主要反应是:S+2KNO3+3C═K2S+3CO2↑+N2↑,下列说法不正确的是( )
| A. | 每生成0.5 mol N2,反应中转移6 mol电子 | |
| B. | 硝酸钾、硫磺在黑火药爆炸的反应中是氧化剂 | |
| C. | KNO3有强氧化性,乘坐汽车、火车、飞机时不能随身携带 | |
| D. | 上述反应的生成物都是无毒的,所以燃放爆竹时不会污染环境 |
