题目内容
11.汞俗称水银,在常沮下呈液态,已知:①在硝酸汞[Hg(NO3)2]溶液中插入一块已清洗掉氧化摸的铝片,片刻后,观察到铝片表面有大量“白毛”(生成了汞).②向剧毒的水银表面撒一层硫粉,汞转化成硫化汞(HgS).③工业上,用热分解法冶炼汞:加热氧化汞得到汞蒸气.冷凝收集到汞.下列说法正确的是( )| A. | 在反应①中,生成3mol汞,转移3mol电子 | |
| B. | 在反应②中,硫化汞既是氧化产物,又是还原产物 | |
| C. | 在反应③中,产生11.2L氧气,转移2mol电子 | |
| D. | 由反应③知,汞在空气中加强热会生成氧化汞 |
分析 在硝酸汞[Hg(NO3)2]溶液中插入一块已清洗掉氧化摸的铝片,片刻后,观察到铝片表面有大量“白毛”(生成了汞)反应的方程式为:2Al+3Hg(NO3)2=2Al(NO3)3+3Hg;
②向剧毒的水银表面撒一层硫粉,汞转化成硫化汞(HgS),方程式:Hg+S═HgS;
工业上,用热分解法冶炼汞:加热氧化汞得到汞蒸气,方程式:2HgO$\frac{\underline{\;加热\;}}{\;}$2Hg+O2↑,依据方程式结合氧化还原反应基本概念解答.
解答 解:A.依据方程式:2Al+3Hg(NO3)2=2Al(NO3)3+3Hg,可知生成3mol汞转移6mol电子,故A错误;
B.依据方程式:Hg+S═HgS,可知汞化合价升高,硫化合价降低,所以HgS既是氧化剂又是还原剂,故B正确;
C.2HgO$\frac{\underline{\;加热\;}}{\;}$2Hg+O2↑,题干中为指明气体状态,气体摩尔体积未知,无法计算转移电子的物质的量,故C错误;
D.由2HgO$\frac{\underline{\;加热\;}}{\;}$2Hg+O2↑,可知氧化汞不稳定,受热易分解,汞在空气中加热不能生成氧化汞,故D错误;
故选:B.
点评 本题考查了氧化还原反应,明确物质的性质及发生反应的方程式、熟悉氧化还原反应基本概念是解题关键,题目难度中等.

练习册系列答案
相关题目
7.铁及其化合物在日常生活、生产中应用广泛.
(1)高铁酸钠(Na2FeO4)是水处理过程中的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原成三价铁离子达到净水的目的.按要求回答下列问题:
高铁酸钠主要通过如下反应制取:2Fe(OH)3+3NaClO+4NaOH═2Na2FeO4+3X+5H2O,则X的化学式NaCl.
(2)氧化铁红颜料跟某些油料混合,可以制成防锈油漆.以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如下:
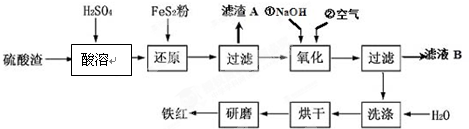
①酸溶过程中Fe2O3与稀硫酸反应的化学方程式为Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;
“滤渣A”主要成份的化学式为SiO2.
②还原过程中加入FeS2的目的是将溶液中的Fe3+还原为Fe2+,而本身被氧化为H2SO4,请完成该反应的离子方程式:FeS2+14Fe3++8H2O═15Fe2++2SO42-+16H+.
③氧化过程中,O2、NaOH与Fe2+反应的离子方程式为4Fe2++O2+2H2O+8OH-=4Fe(OH)3↓.
④为了确保铁红的质量和纯度,氧化过程需要调节溶液的pH的范围是3.2~3.8,如果pH过大,可能引起的后果是Al3+、Mg2+形成沉淀,使制得的铁红不纯(几种离子沉淀的pH见下表);滤液B可以回收的物质有(写化学式)Na2SO4、Al2(SO4)3、MgSO4.
(1)高铁酸钠(Na2FeO4)是水处理过程中的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原成三价铁离子达到净水的目的.按要求回答下列问题:
高铁酸钠主要通过如下反应制取:2Fe(OH)3+3NaClO+4NaOH═2Na2FeO4+3X+5H2O,则X的化学式NaCl.
(2)氧化铁红颜料跟某些油料混合,可以制成防锈油漆.以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如下:

①酸溶过程中Fe2O3与稀硫酸反应的化学方程式为Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;
“滤渣A”主要成份的化学式为SiO2.
②还原过程中加入FeS2的目的是将溶液中的Fe3+还原为Fe2+,而本身被氧化为H2SO4,请完成该反应的离子方程式:FeS2+14Fe3++8H2O═15Fe2++2SO42-+16H+.
③氧化过程中,O2、NaOH与Fe2+反应的离子方程式为4Fe2++O2+2H2O+8OH-=4Fe(OH)3↓.
④为了确保铁红的质量和纯度,氧化过程需要调节溶液的pH的范围是3.2~3.8,如果pH过大,可能引起的后果是Al3+、Mg2+形成沉淀,使制得的铁红不纯(几种离子沉淀的pH见下表);滤液B可以回收的物质有(写化学式)Na2SO4、Al2(SO4)3、MgSO4.
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
4.下列装置能达到实验目的是( )
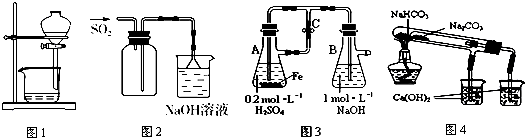

| A. | 图1用于放出碘的苯溶液 | |
| B. | 图2用于实验室收集SO2 | |
| C. | 图3用于实验室制备Fe(OH)2 | |
| D. | 图4用于比较NaHCO3和Na2CO3热稳定性 |
5. 科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图所示),与白磷分子相似.已知断裂 1mol N-N键吸收193kJ热量,断裂 1mol N≡N键吸收941kJ热量,则下列说法不正确的是( )
科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图所示),与白磷分子相似.已知断裂 1mol N-N键吸收193kJ热量,断裂 1mol N≡N键吸收941kJ热量,则下列说法不正确的是( )
 科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图所示),与白磷分子相似.已知断裂 1mol N-N键吸收193kJ热量,断裂 1mol N≡N键吸收941kJ热量,则下列说法不正确的是( )
科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图所示),与白磷分子相似.已知断裂 1mol N-N键吸收193kJ热量,断裂 1mol N≡N键吸收941kJ热量,则下列说法不正确的是( )| A. | N4与N2互为同素异形体 | |
| B. | 1 mol N4气体转化为N2时要放出724 kJ能量 | |
| C. | N4变成N2是化学变化 | |
| D. | N4不可能是分子晶体 |
