题目内容
16.下列关于金刚石、石墨和C60的判断,正确的是( )| A. | 均含共价键 | B. | 性质相同 | C. | 互为同位素 | D. | 互为同分异构体 |
分析 A.单质中碳原子间形成共价键;
B.金刚石、石墨、C60均是由碳元素形成的不同种单质,结构不同,物理性质不同,
C,金刚石、石墨和C60它们互称为同素异形体,不是原子是不同单质;
D.分子式相同结构不同的化有机合物为同分异构体;
解答 解:A、它们都是碳元素的单质,金刚石是碳碳原子间形成共价键连接成网状结构的原子晶体,石墨是层状结构每层上碳原子间形成共价键,C60分子中碳原子间形成的是共价键,故A正确;
B、它们都是碳元素的单质,互称为同素异形体,此三者结构不同,物理性质不同,故B错误;
C、质子数相同,中子数不同的同种元素的原子间互称为同位素,此三者为单质,故C错误;
D、金刚石与石墨是不同的物质,化学式不同不是同分异构体,故D错误,
故选A.
点评 本题主要考查的是同种元素形成的不同种单质之间的相互关系,注意概念实质理解应用,题目难度不大.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案
相关题目
7.氯气常用于生活用水的杀菌,其原因是( )
| A. | 氯气有毒 | |
| B. | 氯气有刺激性气味 | |
| C. | 氯气溶于水,与水反应可生成盐酸 | |
| D. | 氯气溶于水,与水反应生成的次氯酸有强氧化性 |
4.某烃的结构简式为 ,它可能具有的性质是( )
,它可能具有的性质是( )
 ,它可能具有的性质是( )
,它可能具有的性质是( )| A. | 易溶于水,也易溶于有机溶剂 | |
| B. | 既能使溴的四氯化碳溶液褪色,又能使酸性高锰酸钾溶液褪色 | |
| C. | 能发生聚合反应,其产物可表示为 | |
| D. | 1mol该烃能与4molBr2发生加成反应 |
1.现有部分短周期元素的性质或原子结构如下表:
(1)元素X的一种同位素可测定文物年代,这种同位素的中子数是8.
(2)元素Y与R形成一种离子YR${\;}_{4}^{+}$,写出该微粒的电子式: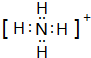 (用元素符号表示).它们还可以形成分子YR3,写出实验室制取该物质的化学方程式:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑
(用元素符号表示).它们还可以形成分子YR3,写出实验室制取该物质的化学方程式:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑
(3)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是②.
①常温下Z的单质和T的单质状态不同
②Z的氢化物比T的氢化物稳定
③一定条件下Z和T的单质都能与氢氧化钠溶液反应.
| 元素编号 | 元素性质或原子结构 |
| R | 原子半径最小的元素 |
| T | M层上有6个电子 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
(2)元素Y与R形成一种离子YR${\;}_{4}^{+}$,写出该微粒的电子式:
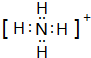 (用元素符号表示).它们还可以形成分子YR3,写出实验室制取该物质的化学方程式:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑
(用元素符号表示).它们还可以形成分子YR3,写出实验室制取该物质的化学方程式:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑(3)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是②.
①常温下Z的单质和T的单质状态不同
②Z的氢化物比T的氢化物稳定
③一定条件下Z和T的单质都能与氢氧化钠溶液反应.
8.常温下,0.1mol•L-1的下列溶液中,有关微粒的物质的量浓度关系正确的是( )
| A. | NH4Cl溶液:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | (NH4)2Fe(SO4)2溶液:c(SO42-)>c(NH4+)>c(Fe2+)>c(H+) | |
| C. | Na2CO3溶液:c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-) | |
| D. | NaHCO3溶液:c(H+)+c(H2CO3)=c(OH-)+c(CO32-) |
5.相同碳原子数的烷烃、烯烃、炔烃,在空气中完全燃烧生成二氧化碳和水,所需空气量的比较中正确的是
( )
( )
| A. | 烷烃最少 | B. | 烯烃最少 | C. | 炔烃最少 | D. | 三者一样多 |
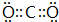
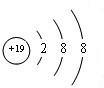 ,C原子的结构示意图为
,C原子的结构示意图为 .
.