题目内容
18. I.氨是合成硝酸、铵盐和氮肥的基本原料,回答下列问题:
I.氨是合成硝酸、铵盐和氮肥的基本原料,回答下列问题:(1)氨的水溶液显弱碱性,其原因为NH3•H2O?NH4++OH-(用离子方程式表示),0.1mol•L-1的氨水中加入少量的NH4Cl固体,溶液的PH降低(填“升高”或“降低”);若加入少量的明矾,溶液中的NH4+的浓度增大(填“增大”或“减小”).
(2)硝酸铵加热分解可得到N2O和H2O,250℃时,硝酸铵在密闭容器中分解达到平衡,该分解反应的化学方程式为NH4NO3$\stackrel{△}{?}$N2O+2H2O,平衡常数表达式为c(N2O)c2(H2O);
Ⅱ.25℃,在0.10mol•L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图(忽略溶液体积的变化、H2S的挥发).
①pH=13时,溶液中的c(H2S)+c(HS-)=0.043mol•L-1.
②某溶液含0.020mol•L-1Mn2+、0.10mol•L-1H2S,当溶液pH=5时,Mn2+开始沉淀.[已知:Ksp(MnS)=2.8×10-13].
分析 I.(1)一水合氨为弱碱,部分电离生成氢氧根离子和铵根离子而显碱性;依据氯化铵、明矾对一水合氨电离平衡移动的影响判断铵根离子浓度大小、pH值变化;
(2)依据所给的反应物和产物,结合元素守恒书写方程式即可,依据反应方程式书写平衡常数表达式;
Ⅱ.①根据溶液pH与c(S2-)关系图pH=13时,c(S2-)=5.7×10-2mol/L,在0.10mol•L-1H2S溶液中根据硫守恒c(H2S)+c(HS-)+c(S2-)=0.10mol•L-1;
解答 解:I.(1)一水合氨为弱碱,部分电离生成氢氧根离子和铵根离子而显碱性,电离方程式为:NH3•H2O?NH4++OH-;加入氯化铵固体,氨根离子浓度增大,平衡逆向移动,氢氧根离子浓度降低,溶液pH值降低;
加入明矾,明矾电离产生的铝离子结合氢氧根离子,使一水合氨电离平衡向正向移动,氨根离子浓度增大;
故答案为:NH3•H2O?NH4++OH- 降低 增大;
(2)硝酸铵分解生成N2O和H2O,达到平衡,说明为可逆反应,化学反应方程式为:NH4NO3$\stackrel{△}{?}$N2O+2H2O,250℃时,水为气体状态,NH4NO3为固态,则平衡常数K=c(N2O)×c2(H2O),
故答案为:NH4NO3$\stackrel{△}{?}$N2O+2H2O;c(N2O)c2(H2O);
Ⅱ.①根据溶液pH与c(S2-)关系图pH=13时,c(S2-)=5.7×10-2mol/L,在0.10mol•L-1H2S溶液中根据硫守恒c(H2S)+c(HS-)+c(S2-)=0.10mol•L-1,所以c(H2S)+c(HS-)=0.1-5.7×10-2=0.043mol/L,
故答案为:0.043;
②当Qc=Ksp(MnS)时开始沉淀,所以c(S2-)=$\frac{Ksp(MnS)}{c(M{n}^{2}{\;}^{+})}$=$\frac{2.8×10{\;}^{-13}}{0.020}$mol/L=1.4×10-11mol/L,结合图象得出此时的pH=5,所以pH=5时锰离子开始沉淀,
故答案为:5.
点评 本题为综合题,考查了弱电解质电离及影响电离平衡移动的因素,电离平衡常数表达式的书写,溶度积规则,题目难度中等,明确有关化学平衡理论是解题关键.

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案| A. | 向明矾溶液中加入过量的氢氧化钡溶液:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O | |
| B. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| C. | 碳酸氢钙与少量澄清石灰水反应:Ca2++2OH-+2HCO3-═CaCO3↓+CO32-+2H2O | |
| D. | 强碱溶液中,次氯酸钠与Fe(OH)2:3ClO-+2Fe(OH)2═2FeO42-+3Cl-+H2O+4H+ |
| A. | 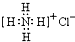 :可以表示氯化铵的电子式 :可以表示氯化铵的电子式 | |
| B. |  :可以表示中子数为18的氯原子结构示意图 :可以表示中子数为18的氯原子结构示意图 | |
| C. | 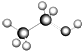 :可以表示乙醇分子的球棍模型 :可以表示乙醇分子的球棍模型 | |
| D. |  :既可以表示甲烷分子,也可以表示四氯化碳分子 :既可以表示甲烷分子,也可以表示四氯化碳分子 |
| A. | 动物皮革的主要成分是蛋白质 | |
| B. | 天然蛋白质水解的最终产物是α氨基酸 | |
| C. | 皮革鞣制过程中使用的浓HNO3会使蛋白质盐析 | |
| D. | “皮革奶”灼烧时有烧焦羽毛的气味 |
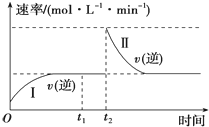 在一恒温恒压的密闭容器中发生如下反应:A(g)+B(g)?2C(g)△H<0,t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程如图所示.下列说法不正确的是( )
在一恒温恒压的密闭容器中发生如下反应:A(g)+B(g)?2C(g)△H<0,t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程如图所示.下列说法不正确的是( )| A. | 0~t2时,v(正)>v(逆) | |
| B. | Ⅰ、Ⅱ两过程达到平衡时,A的体积分数Ⅰ=Ⅱ | |
| C. | t2时刻改变的条件是向密闭容器中加C | |
| D. | Ⅰ、Ⅱ两过程达到平衡时,平衡常数K(Ⅰ)=K(Ⅱ) |
| A. | 焰色反应反映出物质的化学性质 | |
| B. | 所有金属及其化合物灼烧时火焰均有颜色 | |
| C. | 焰色反应均应透过蓝色钴玻璃观察 | |
| D. | NaCl与Na2CO3灼烧时火焰颜色相同 |
| A. | 氯元素的近似相对原子质量为35 | B. | 氯元素的某种同位素的质量数为35 | ||
| C. | 氯元素的中子数为18 | D. | 氯原子的质量为34.969 |
 回答下列问题:
回答下列问题: