题目内容
20.我国科学家在世界上首次合成三种新核素,其中一种新核素的名称是铪-185,关于铪-185,下列说法中正确的是( )①是一种新元素 ②是一种新原子 ③原子核内有185个质子 ④是铪-180的一种新的核素.
| A. | ①和③ | B. | ②和④ | C. | ②和③ | D. | ③和④ |
分析 185Hf是一种原子,其质量数为185,质子数为72,中子数=质量数-质子数,质子数相同,中子数不同的原子互为同位素.
解答 解:①185Hf是一种原子,而不是新元素,是新的核素,故①错误;
②185Hf是一种原子,其质量数为185,质子数为72,是一种新的原子,故②正确;
③185Hf是一种原子,其质子数为72,故③错误;
④185Hf和180Hf的质子数都是72,中子数不同,则互为同位素,即是180Hf的一种新的同位素,故④正确;
故选B.
点评 本题较简单,考查核素、元素、同位素的关系,明确原子中的数字的意义及原子中量的关系即可解答.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.已知 T、X、Y、Z 是中学化学常见的四种元素,其结构或性质信息如表:
请根据信息回答有关问题:
(1)写出这四种元素能形成的常见配体CN-、Cl-;(写两种)
(2)T、X、Y三种元素的由负性由大到小的顺序(填元素符号)是N>C>Na,第一电离能由大到小的顺序是N>C>Na;
(3)元素Q的原子序数是X与Z的原子序数之和.
①该元素基态原子的外围电子排布式为3d84s2;
②元素Q与元素T、Y、Z分别形成平面型的[Q(TY)4]2- 和四面体的[QZ4]2-,Q的配位数为4,其中Q与 Z 成键时中心原子采用的杂化方式是sp3.
| 元素 | 结构或性质信息 |
| T | 原子的L层上s电子数等于p 电子数 |
| X | 元素的原子半径是第三周期主族元素中最大的 |
| Y | 空气中含其单质,原子的最外层未成对电子数是该元素所在周期中最多的 |
| Z | 单质常温、常压下是气体.原子的M层上有1个未成对的p电子 |
(1)写出这四种元素能形成的常见配体CN-、Cl-;(写两种)
(2)T、X、Y三种元素的由负性由大到小的顺序(填元素符号)是N>C>Na,第一电离能由大到小的顺序是N>C>Na;
(3)元素Q的原子序数是X与Z的原子序数之和.
①该元素基态原子的外围电子排布式为3d84s2;
②元素Q与元素T、Y、Z分别形成平面型的[Q(TY)4]2- 和四面体的[QZ4]2-,Q的配位数为4,其中Q与 Z 成键时中心原子采用的杂化方式是sp3.
15.可逆反应:2NO2(g)?2NO(g)+O2(g),在体积不变的密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n mol NO
③用NO2、NO、O2表示的反应速率数值之比为2:2:1的状态
④混合气体的颜色不再改变的状态.
①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n mol NO
③用NO2、NO、O2表示的反应速率数值之比为2:2:1的状态
④混合气体的颜色不再改变的状态.
| A. | ①④ | B. | ②③ | C. | ①③④ | D. | ①②③④ |
5.为探究锌与稀硫酸的反应速率[ν(H2)],向反应混合液中加入某些物质,下列判断正确的是( )
| A. | 加入NaHSO4固体,ν(H2)不变 | B. | 加入少量水,ν(H2)减小 | ||
| C. | 加入CH3COONa固体,ν(H2)不变 | D. | 滴加少量CuSO4溶液,ν(H2)减小 |
12.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 1L 0.1mol•L-1FeCl3溶液中含有的Fe3+离子数目为0.1NA | |
| B. | 室温下,1L pH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA | |
| C. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O反应中,生成28g N2时,转移的电子数目为3.75NA | |
| D. | 常温下,2.24LCl2完全与NaOH溶液反应,转移的电子数目一定为0.1NA |
9.下列叙述正确的是( )
| A. | 1 mol H2SO4的质量为98g•mol-1 | |
| B. | H2SO4的摩尔质量为98g | |
| C. | 6.02×1022个H2SO4分子的质量为9.8g | |
| D. | 9.8 g H2SO4含有6.02×1023个H2SO4分子 |

 ,C是极性(极性、非极性)分子,D分子的空间构型为三角锥形.
,C是极性(极性、非极性)分子,D分子的空间构型为三角锥形.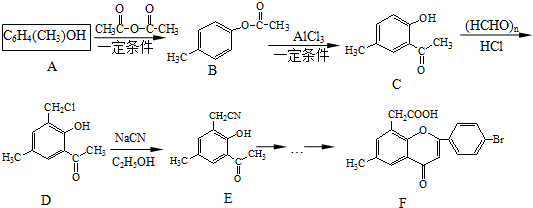
 .
. .
.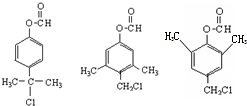 .
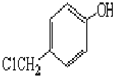
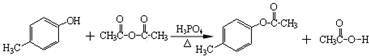
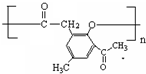
.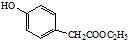 )是一种重要的医药中间体.完成以A和乙醇为主要原料制备对羟基苯乙酸乙酯的合成路线流程图(无机试剂任选).
)是一种重要的医药中间体.完成以A和乙醇为主要原料制备对羟基苯乙酸乙酯的合成路线流程图(无机试剂任选).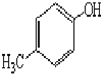 $→_{一定条件}^{Cl_{2}}$
$→_{一定条件}^{Cl_{2}}$