题目内容
在反应2FeCl3+Fe=3FeCl2中,被氧化的元素和氧化剂分别是( )
| A、Fe和Fe |
| B、Cl和FeCl3 |
| C、Fe和FeCl3 |
| D、Cl和Fe |
考点:氧化还原反应
专题:氧化还原反应专题
分析:根据元素化合价的变化判断,元素的化合价升高时被氧化,有元素的化合价降低的物质为氧化剂.
解答:
解:在反应2FeCl3+Fe=3FeCl2中,Fe的化合价为0价,反应后升高为+2价,则Fe元素被氧化,FeCl3中Fe元素为+3价,反应后化合价降低,则FeCl3为氧化剂,
故选C.
故选C.
点评:本题考查了氧化还原反应的有关知识,侧重于基本概念的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
将偏铝酸钠溶液和盐酸等体积混合,得到的沉淀物中铝元素的质量与溶液中所含铝元素的质量相等,则原偏铝酸钠溶液和盐酸的物质的量浓度之比可能是( )
| A、1:3 | B、2:1 |
| C、1:4 | D、2:5 |
Fe(OH)3胶体稳定存在的主要原因是( )
| A、胶粒直径小于1nm |
| B、胶粒做布朗运动 |
| C、胶粒带正电荷 |
| D、胶粒不能透过半透膜 |
下列说法中,可以证明反应N2+3H2?2NH3已达到平衡状态的是( )
①1个N≡N键断裂的同时有3个H-H键形成
②N2、H2、NH3的分子数之比为1:3:2
③1个N≡N键断裂的同时有6个N-H键形成
④N2、H2、NH3的浓度不再变化.
①1个N≡N键断裂的同时有3个H-H键形成
②N2、H2、NH3的分子数之比为1:3:2
③1个N≡N键断裂的同时有6个N-H键形成
④N2、H2、NH3的浓度不再变化.
| A、①④ | B、②③ | C、①③ | D、②④ |
配制100mL0.100mol/LNaOH溶液时,下列操作造成浓度偏高的是①在纸上称量 ②没有冲洗玻璃棒和烧杯2-3次 ③定容时俯视刻度线 ④转移时有少量溶液溅出( )
| A、③ | B、①②③ | C、①②④ | D、②③ |
下列有机物的命名正确的是( )
| A、Br-CH2-CH2-Br二溴乙烷: |
B、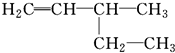 3-乙基-1-丁烯: 3-乙基-1-丁烯: |
C、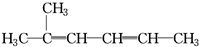 2-甲基-2,4-己二烯: 2-甲基-2,4-己二烯: |
D、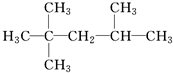 2,2,3-三甲基戊烷: 2,2,3-三甲基戊烷: |
氨能跟氧气在铂催化下反应生成硝酸和水,其中第一步反应为:4NH3+5O2═4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(H2O)[mol?L-1?min-1]表示,则正确的关系是( )
| A、4v(NH3)=5v(O2) |
| B、5v(O2)=6v(H2O) |
| C、2v(NH3)=3v(H2O) |
| D、4v(O2)=5v(NO) |
氨氧化制硝酸,吸收塔内发生反应 3NO2(g)+H2O(l)?2HNO3(aq)+NO△H<0 要提高反应的转化率,增加浓硝酸的产量,应采取的措施( )
| A、加压 | B、加大水量 |
| C、升温 | D、减压 |