题目内容
9.氮的氧化物(如NO2、N2O4、N2O5等)应用很广.在一定条件下可以相互转化.(1)N2O5可通过电解或臭氧氧化N2O4的方法制备.电解装置如图所示(隔膜用于阻止水分子通过),其阳极反应式为N2O4+2HNO3-2e-═2N2O5+2H+..
已知:2NO(g)+O2(g)=2NO2(g)△H1
NO(g)+O3(g)=NO2(g)+O2(g)△H2
2NO2(g)?N2O4(g)△H3
2N2O5(g)=4NO2(g)+O2(g)△H4
则反应N2O4(g)+O2(g)=N2O5(g)+O2(g)的△H=△H2-$\frac{1}{2}$△H1-△H3-$\frac{1}{2}$△H4
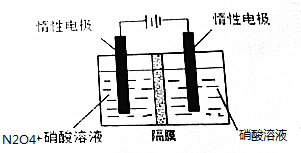
分析 (1)由N2O4制取N2O5需要失去电子,所以N2O5在阳极区生成,N2O4在阳极发生氧化反应失去电子生成N2O5;
(2)①2NO(g)+O2(g)═2NO2(g)△H1
②NO(g)+O3(g)═NO2(g)+O2(g)△H2
③2NO2(g)?N2O4(g)△H3
④2N2O5(g)═4NO2(g)+O2(g)△H4
将方程式②-$\frac{1}{2}$①-③-$\frac{1}{2}$④得N2O4(g)+O3(g)═N2O5(g)+O2(g),焓变进行相应的改变.
解答 解:(1)从电解原理来看,N2O4制备N2O5为氧化反应,则N2O5应在阳极区生成,反应式为N2O4+2HNO3-2e-═2N2O5+2H+,
故答案为:N2O4+2HNO3-2e-═2N2O5+2H+;
(2)①2NO(g)+O2(g)═2NO2(g)△H1
②NO(g)+O3(g)═NO2(g)+O2(g)△H2
③2NO2(g)?N2O4(g)△H3
④2N2O5(g)═4NO2(g)+O2(g)△H4
将方程式②-$\frac{1}{2}$①-③-$\frac{1}{2}$④得N2O4(g)+O3(g)═N2O5(g)+O2(g),
则该反应△H=△H2-$\frac{1}{2}$△H1-△H3-$\frac{1}{2}$△H4,
故答案为:△H2-$\frac{1}{2}$△H1-△H3-$\frac{1}{2}$△H4.
点评 本题为综合题,涉及电解池工作原理、反应热的计算,为高频考点,明确电解池工作原理、能够由已知方程式正确构建目标方程式是解本题关键,侧重考查学生分析计算能力,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.下列离子方程式正确的是( )
| A. | 混合小苏打和烧碱溶液 HCO3-+H+═H2O+CO2↑ | |
| B. | 氯化铝溶液中加入氨水Al3++3OH-═Al(OH)3↓ | |
| C. | 加热碳酸氢钙溶液 Ca2++2HCO3-═CaCO3↓+H2O+CO2↑ | |
| D. | 氢氧化镁中加入稀硫酸H++OH-═H2O |
5.下列离子在溶液中可以大量共存的一组是( )
| A. | H+、Na+、OH- | B. | Na+、NO3-、Cl- | ||
| C. | K+、H+、HCO3- | D. | Ca2+、SO42-、CO32- |
2.下列说法不正确的是( )
| A. | 现代化学元素分析测试中,可用元素分析仪确定物质中是否含有C、H、O、N、S、Cl、Br等元素,用红外光谱仪确定物质中是否存在某些有机原子团,用原子吸收光谱确定物质中含有哪些金属元素等 | |
| B. | 钠钾合金在常温下是液体,可用于快中子反应堆作剂;镁合金大量用于制造火箭、导弹和飞机的部件等 | |
| C. | 2015年浙江省多地遭遇雾霾天气,有报道称雾霾颗粒中汽车尾气占20%以上,一致汽车尾气中的主要污染物为NOx、CO、燃烧源超细颗粒(PM2.5)等有害物质,其中PM2.5(OM单位为百万分之一米)颗粒大小约等于胶体粒子 | |
| D. | 如图所示为四大基本反应及其关系,则反应4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O属于区域3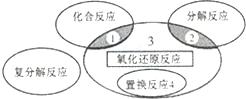 |
3.下列排列顺序正确的是( )
| A. | 粒子半径:F-<Mg2+<Al3+ | B. | 热稳定性:HI>HBr>HCl>HF | ||
| C. | 酸性:H2SiO3<H3PO4<H2SO4<HClO4 | D. | 碱性:Al(OH)3>Mg(OH)2>NaOH |
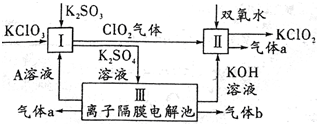 氯酸钾(KC1O3)和亚氯酸钾(KClO2)可以相互转化,KClO2在碱性环境中能稳定存在,生产KClO2的主要流程如图所示.
氯酸钾(KC1O3)和亚氯酸钾(KClO2)可以相互转化,KClO2在碱性环境中能稳定存在,生产KClO2的主要流程如图所示.
