题目内容
4.X、Y、Z、Q、M为常见的短周期元素,其原子序数依次增大.有关信息如表:| X | 动植物生长不可缺少的元素,是蛋白质的重要成分 |
| Y | 地壳中含量居第一位 |
| Z | 短周期中其原子半径最大 |
| Q | 生活中大量使用其合金制品,工业上可用电解其氧化物的方法制备其单质 |
| M | 海水中大量富集的元素之一,其最高正化合价与负价的代数和为6 |
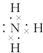 .
.(2)已知37Rb和53I都位于第五周期,分别与Z和M同一主族.下列有关说法正确的是ACD(填序号).
A.原子半径:Rb>I
B.RbM中含有共价键
C.气态氢化物热稳定性:M>I
D.Rb、Q、M的最高价氧化物对应的水化物可以两两发生反应
(3)化合物QX导热性好,热膨胀系数小,是良好的耐热冲击材料.有关化合物QX的制备及化学性质如下(所有热量数据均已折合为25℃、101.3 kPa条件下的数值).
①可用Q和X的单质在800~1 000℃制得,每生成1mol QX,吸收a kJ的热量.
②可用Q的氧化物、焦炭和X的单质在1 600~1750℃生成QX,每消耗18g碳生成1mol QX,吸收bkJ的热量.
请根据上述信息写出在理论上Q的氧化物跟焦炭反应生成Q单质和CO的热化学方程式3C(s)+Al2O3(s)═2Al(s)+3CO(g)△H=2b-2a kJ•mol-1.
(4)X、Y组成的一种无色气体遇空气变为红棕色.标准状况下将40 L该无色气体与15 L氧气通入一定浓度的NaOH溶液中,恰好被完全吸收,同时生成两种盐.请写出该反应的离子方程式8NO+3O2+8OH-=2NO3-+6NO2-+4H2O.
分析 X、Y、Z、Q、M为常见的短周期元素,其原子序数依次增大.Y在地壳中含量居第一位,则Y为O元素;X是动植物生长不可缺少的元素,是蛋白质的重要成分,则X为N元素;短周期中Z的原子半径最大,则Z为Na;Q是生活中大量使用其合金制品,工业上可用电解其氧化物的方法制备其单质,则Q为Al;M是海水中大量富集的元素之一,其最高正化合价与负价的代数和为6,则M为Cl.
解答 解:X、Y、Z、Q、M为常见的短周期元素,其原子序数依次增大.Y在地壳中含量居第一位,则Y为O元素;X是动植物生长不可缺少的元素,是蛋白质的重要成分,则X为N元素;短周期中Z的原子半径最大,则Z为Na;Q是生活中大量使用其合金制品,工业上可用电解其氧化物的方法制备其单质,则Q为Al;M是海水中大量富集的元素之一,其最高正化合价与负价的代数和为6,则M为Cl.
(1)X的气态氢化物为NH3,其电子式为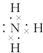 ,
,
故答案为: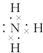 ;
;
(2)A.Rb与Na同位于第ⅠA族,I与Cl同位于第ⅦA族,二者位于同一周期,Rb原子序数小于I,故Rb半径大于I半径,故A正确;
B.RbCl中存在离子键,故B错误;
C.Cl的非金属性大于I,故HCl的热稳定性强于HI,故C正确;
D.RbOH显强碱性,Al(OH)3显两性,HClO4显强酸性,故两两均可发生反应,故D正确.
故选:ACD;
(3)根据条件可得热化学方程式:①.2Al(s)+N2(g)$\frac{\underline{\;800-1000℃\;}}{\;}$ 2AlN(s)△H=2a kJ•mol-1,
②.Al2O3(s)+3C(s)+N2(g)$\frac{\underline{\;1600-1750℃\;}}{\;}$ 2AlN(s)+3CO(g)△H=2b kJ•mol-1,
根据盖斯定律,②-①即可得目标方程:3C(s)+Al2O3(s)═2Al(s)+3CO(g)△H=2b-2a kJ•mol-1,
故答案为:3C(s)+Al2O3(s)═2Al(s)+3CO(g)△H=2b-2a kJ•mol-1;
(4)由X、Y组成的无色气体为NO,红棕色气体为NO2,同时生成两种盐,生成硝酸钠、亚硝酸钠,令硝酸钠、亚硝酸钠的物质的量分别为xmol、ymol,则:$\left\{\begin{array}{l}{x+y=\frac{40}{22.4}}\\{3x+y=\frac{15}{22.4}}\end{array}\right.$,解得x:y=1:3,故反应离子方程式为:8NO+3O2+8OH-=2NO3-+6NO2-+4H2O,
故答案为:8NO+3O2+8OH-=2NO3-+6NO2-+4H2O.
点评 本题考查结构性质位置关系应用,题目比较综合,涉及电子式、元素周期律、热化学方程式、氧化还原反应计算与离子方程式书写等,(4)中关键是计算硝酸钠与亚硝酸钠的物质的量关系.

Ⅰ.向菱锰矿中加入过量稀H2SO4,过滤;
Ⅱ.向滤液中加入过量MnO2,过滤;
Ⅲ.调节滤液pH=a,过滤;
Ⅳ.浓缩、结晶、分离、干燥得到产品;
Ⅴ.检验产品纯度.
(1)步骤Ⅰ中,滤渣的主要成分是SiO2.
(2)将MnO2氧化Fe2+的离子方程式补充完整:
1MnO2+2Fe2++4H+=1 Mn2++2Fe3++2H2O
(3)与选用Cl2作为氧化剂相比,MnO2的优势主要在于:原料来源广、成本低、可避免环境污染、不会引入Cl-,使制得的MnSO4?H2O产品更纯净.
(4)已知:
生成氢氧化物沉淀的pH
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 | 7.6 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 | 10.2 |
步骤Ⅲ中a的取值范围是4.7≤a<7.6.
(5)步骤Ⅴ,通过测定产品中锰元素的质量分数来判断产品纯度.
已知一定条件下,MnO4-与Mn2+反应生成MnO2.取x g产品配成溶液,用0.1mol/L KMnO4溶液滴定,消耗KMnO4溶液y mL,产品中锰元素的质量分数为$\frac{1.5y×1{0}^{-4}×55}{x}$.
| A. | CH2═CH2与CH3CH2OH均可以使KMnO4(H+)褪色,且褪色原理相同 | |
| B. | 乙酸乙酯的制取中,水浴加热的目的有:加快化学反应速率,同时使产物分离,平衡正向移动 | |
| C. | 等质量的CH3CH2OH与CH3COOH,均能与足量的金属钠发生取代反应,前者反应速率较后者慢,且生成等物质量的H2 | |
| D. | 在一溴乙烷中加入NaOH和CH3CH2OH,加热,加入HNO3酸化的AgNO3,出现淡黄色沉淀,说明溴乙烷发生了水解反应 |
| A. | 2:4:3 | B. | 2:4:5 | C. | 2:4:7 | D. | 3:5:8 |

(1)制备氯气选用的药品为固体二氧化锰和浓盐酸,则相关的化学反应方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O装置B中饱和食盐水的作用是除去Cl2中的HCl;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象B中长颈漏斗中液面上升,形成水柱.
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入d.
| a | b | c | d | |
| I | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
| A. | 该溶液中,Na+、H+、Cl-、SCN-可以大量共存 | |
| B. | 通入H2S气体至过量会生成两种沉淀 | |
| C. | 加入NaOH溶液至Fe3+刚好沉淀完全的离子方程式:NH4++Fe3++4OH-═Fe(OH)3↓+NH3•H2O | |
| D. | 离子浓度关系:c(SO42-)>c(NH4+)>c(Fe3+ )>c(H+ )>c(OH-) |
 .
.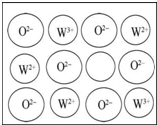 X、Y、Z、W四种元素原子序数依次增大且均小于36.Z基态原子最外层电子数是其内层电子总数的3倍,Y基态原子是同周期元素中未成对电子数最多的原子,X分别与Y、Z元素组合均可形成10电子微粒,W基态原子有10个价电子.回答下列问题(以下问题均以推知元素符号作答):
X、Y、Z、W四种元素原子序数依次增大且均小于36.Z基态原子最外层电子数是其内层电子总数的3倍,Y基态原子是同周期元素中未成对电子数最多的原子,X分别与Y、Z元素组合均可形成10电子微粒,W基态原子有10个价电子.回答下列问题(以下问题均以推知元素符号作答):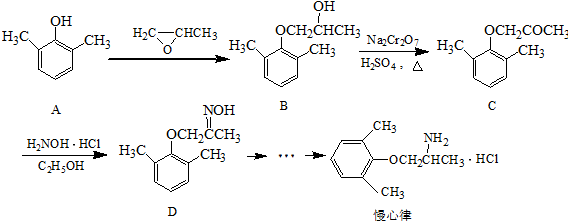
 .
. .
. .
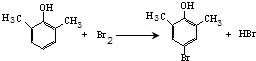
. ).写出以邻甲基苯酚(
).写出以邻甲基苯酚(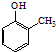 )和乙醇为原料制备
)和乙醇为原料制备 的合成路线流程图(无机试剂任用).
的合成路线流程图(无机试剂任用).