题目内容
14.下列有关NH4Fe(SO4)2溶液的叙述正确的是( )| A. | 该溶液中,Na+、H+、Cl-、SCN-可以大量共存 | |
| B. | 通入H2S气体至过量会生成两种沉淀 | |
| C. | 加入NaOH溶液至Fe3+刚好沉淀完全的离子方程式:NH4++Fe3++4OH-═Fe(OH)3↓+NH3•H2O | |
| D. | 离子浓度关系:c(SO42-)>c(NH4+)>c(Fe3+ )>c(H+ )>c(OH-) |
分析 A.三价铁离子与SCN-可发生络合反应;
B.通入H2S气体,反应生成硫单质、硫酸亚铁和硫酸铵;
C.加入NaOH溶液至Fe3+刚好沉淀完全,此时铵根离子未参加反应;
D.硫酸铁铵为强电解质,完全电离生成铵根离子、三价铁离子、硫酸根离子,三价铁离子、铵根离子水解,三价铁离子水解能力强于铵根离子,据此分析解答.
解答 解:A.NH4Fe(SO4)2溶液含有三价铁离子,三价铁离子与SCN-可发生络合反应,二者不能共存,故A错误;
B.通入H2S气体至过量会生成一种沉淀,即硫单质,故B错误;
C.加入NaOH溶液至Fe3+刚好沉淀完全的离子方程式:Fe3++3OH-═Fe(OH)3↓,故C错误;
D.硫酸铁铵为强电解质,1mol硫酸铁铵完全电离生成1mol铵根离子、1mol三价铁离子、2mol硫酸根离子,三价铁离子、铵根离子都是弱碱阳离子,都发生水解,所以溶液呈酸性,氢离子浓度大于氢氧根子浓度,三价铁离子水解能力强于铵根离子,所以氨根离子浓度大于三价铁离子浓度,所以离子浓度大小关系为:c(SO42-)>c(NH4+)>c(Fe3+ )>c(H+ )>c(OH-),故D正确;
故选:D.
点评 本题考查了铵盐的性质,明确硫酸铁铵的电离方式,明确铵根离子、三价铁离子性质是解题关键,注意三价铁离子水解能力强于铵根离子,题目难度中等.

练习册系列答案
相关题目
4.X、Y、Z、Q、M为常见的短周期元素,其原子序数依次增大.有关信息如表:
(1)X的气态氢化物的大量生产曾经解决了地球上因粮食不足而导致的饥饿和死亡问题,请写出该气态氢化物的电子式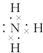 .
.
(2)已知37Rb和53I都位于第五周期,分别与Z和M同一主族.下列有关说法正确的是ACD(填序号).
A.原子半径:Rb>I
B.RbM中含有共价键
C.气态氢化物热稳定性:M>I
D.Rb、Q、M的最高价氧化物对应的水化物可以两两发生反应
(3)化合物QX导热性好,热膨胀系数小,是良好的耐热冲击材料.有关化合物QX的制备及化学性质如下(所有热量数据均已折合为25℃、101.3 kPa条件下的数值).
①可用Q和X的单质在800~1 000℃制得,每生成1mol QX,吸收a kJ的热量.
②可用Q的氧化物、焦炭和X的单质在1 600~1750℃生成QX,每消耗18g碳生成1mol QX,吸收bkJ的热量.
请根据上述信息写出在理论上Q的氧化物跟焦炭反应生成Q单质和CO的热化学方程式3C(s)+Al2O3(s)═2Al(s)+3CO(g)△H=2b-2a kJ•mol-1.
(4)X、Y组成的一种无色气体遇空气变为红棕色.标准状况下将40 L该无色气体与15 L氧气通入一定浓度的NaOH溶液中,恰好被完全吸收,同时生成两种盐.请写出该反应的离子方程式8NO+3O2+8OH-=2NO3-+6NO2-+4H2O.
| X | 动植物生长不可缺少的元素,是蛋白质的重要成分 |
| Y | 地壳中含量居第一位 |
| Z | 短周期中其原子半径最大 |
| Q | 生活中大量使用其合金制品,工业上可用电解其氧化物的方法制备其单质 |
| M | 海水中大量富集的元素之一,其最高正化合价与负价的代数和为6 |
 .
.(2)已知37Rb和53I都位于第五周期,分别与Z和M同一主族.下列有关说法正确的是ACD(填序号).
A.原子半径:Rb>I
B.RbM中含有共价键
C.气态氢化物热稳定性:M>I
D.Rb、Q、M的最高价氧化物对应的水化物可以两两发生反应
(3)化合物QX导热性好,热膨胀系数小,是良好的耐热冲击材料.有关化合物QX的制备及化学性质如下(所有热量数据均已折合为25℃、101.3 kPa条件下的数值).
①可用Q和X的单质在800~1 000℃制得,每生成1mol QX,吸收a kJ的热量.
②可用Q的氧化物、焦炭和X的单质在1 600~1750℃生成QX,每消耗18g碳生成1mol QX,吸收bkJ的热量.
请根据上述信息写出在理论上Q的氧化物跟焦炭反应生成Q单质和CO的热化学方程式3C(s)+Al2O3(s)═2Al(s)+3CO(g)△H=2b-2a kJ•mol-1.
(4)X、Y组成的一种无色气体遇空气变为红棕色.标准状况下将40 L该无色气体与15 L氧气通入一定浓度的NaOH溶液中,恰好被完全吸收,同时生成两种盐.请写出该反应的离子方程式8NO+3O2+8OH-=2NO3-+6NO2-+4H2O.
19.NA代表阿伏加德罗常数.下列说法正确的是( )
| A. | 8.0gCuO和Cu2S的混合物含铜原子个数为0.2NA | |
| B. | 标准状况下,11.2 L乙醇蒸气含共价键数目为4NA | |
| C. | 1mol K与O2完全反应生成K2O、K2O2、KO3的混合物,转移电子数为NA | |
| D. | 1L 0.2 mol•L-1 NH4ClO4溶液中含NH4+数目为0.2NA |
3.下列说法不正确的是( )
| A. | 向煤中加入适量CaO,可大大减少燃烧产物中SO2的量 | |
| B. | 葡萄酒中的花青素在碱性环境下显蓝色,故可用苏打粉检验假红酒 | |
| C. | 石油裂解、煤的干馏、玉米制醇、蛋白质的变性和纳米银粒子的聚集都是化学变化 | |
| D. | 燃料的脱硫脱氮、SO2的回收利用和NOx的催化转化都是减少酸雨产生的措施 |
1.常温下,有下列四种溶液:
下列说法正确的是( )
| ① | ② | ③ | ④ |
| 0.1mol/L NaOH溶液 | pH=11 NaOH溶液 | 0.1mol/L CH3COOH溶液 | pH=3 CH3COOH溶液 |
| A. | 由水电离出H+的浓度c(H+):①>③ | |
| B. | 将④加蒸馏水稀释至原来的100倍时,所得溶液的pH=5 | |
| C. | ①与③混合,若溶液pH=7,则体积V(NaOH)>V(CH3COOH) | |
| D. | 将②与④等体积混合,各离子浓度的关系为:c(CH3COO-)+c(OH-)=c(Na+)+c(H+) |
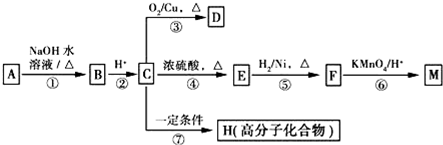
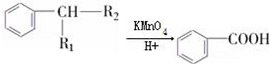 (R1、R2表示烃基或氢原子)
(R1、R2表示烃基或氢原子)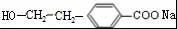 .
.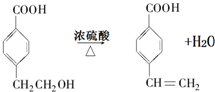 .
. .
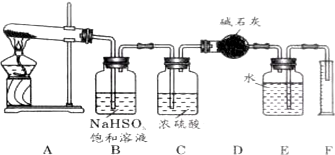
.
 推测硒在元素周期表中第四周期;
推测硒在元素周期表中第四周期;