题目内容
9. 如图所示,若电解5min时铜电极质量 增加2.16g,试回答:
如图所示,若电解5min时铜电极质量 增加2.16g,试回答:(1)电源电极X名称为负极.
(2)电极反应:
A阳极:2Cl--2e-=Cl2
阴极:2H++2e-=H2
B阳极:4OH--4e-═2H2O+O2↑
阴极:Cu2++2e-=Cu、2H++2e-=H2
C阳极:Ag-e-═Ag+
阴极:Ag++e-=Ag
(3)通电5min时,B中共收集224mL气体(标况),溶液体积为200mL.(设电解前后无体积变化)则通电前CuSO4溶液的物质的量浓度为0.025mol•L-1.
(4)若A中KCl溶液的体积也是200mL,电解后,溶液的pH是13(设前后体无体积变化.
分析 (1)由铜电极的质量增加,则Cu电极为阴极,可知X为电源的负极;
(2)A中电解氯化钾,阳极氯离子失电子放出氯气,阴极氢离子得电子放出氢气;
B中电解硫酸铜和硫酸钾溶液,阳极电极反应式为4OH--4e-═2H2O+O2↑,阴极铜离子、氢离子得电子;
C中电解硝酸银溶液,阳极电极反应式为Ag-e-═Ag+,阴极银离子得电子析出银;
(3)B中阳极反应为4OH--4e-═2H2O+O2↑,根据电极反应及电子守恒来计算;
(4)A中发生2KCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2KOH+H2↑+Cl2↑,根据A中的电极反应及与C中转移的电子守恒来计算.
解答 解:(1)由铜电极的质量增加,发生Ag++e-═Ag,则Cu电极为阴极,Ag为阳极,Y为正极,可知X为电源的负极,故答案为:负极;
(2)A中电解氯化钾,阳极氯离子失电子放出氯气,电极反应式为2Cl--2e-=Cl2,阴极氢离子得电子放出氢气,电极反应式为2H++2e-=H2;
B中电解硫酸铜和硫酸钾溶液,阳极电极反应式为4OH--4e-═2H2O+O2↑,阴极铜离子、氢离子得电子,电极反应式为Cu2++2e-=Cu、2H++2e-=H2;
C中电解硝酸银溶液,阳极电极反应式为Ag-e-═Ag+,阴极银离子得电子析出银,电极反应式为Ag++e-=Ag;
故答案为:2Cl--2e-=Cl2;2H++2e-=H2;4OH--4e-═2H2O+O2↑;Cu2++2e-=Cu、2H++2e-=H2;Ag-e-═Ag+;Ag++e-=Ag;
(3)C中阴极反应为Ag++e-═Ag,n(Ag)=$\frac{2.16g}{108g/mol}$=0.02mol,则转移的电子为0.02mol,
B中阳极反应为4OH--4e-═2H2O+O2↑,则转移0.02mol电子生成氧气为0.005mol,其体积为0.005mol×22.4L/mol=0.112L=112mL,
则在阴极也生成112mL气体,由2H++2e-═H2↑,则氢气的物质的量为0.005mol,该反应转移的电子为0.01mol,
则Cu2++2e-═Cu中转移0.01mol电子,所以Cu2+的物质的量为0.005mol,通电前c(CuSO4)=$\frac{0.005mol}{0.2L}$=0.025 mol•L-1;
故答案为:0.025mol•L-1;
(4)A中发生2KCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2KOH+H2↑+Cl2↑,由电子守恒可知,转移0.02mol电子时生成0.02molKOH,忽略溶液体积的变化,
则c(OH-)=$\frac{0.02mol}{0.2L}$=0.1mol•L-1,溶液pH=13,
故答案为:13.
点评 本题考查电解原理,明确Cu电极的质量增加是解答本题的突破口,并明确发生的电极反应及电子守恒即可解答,注意计算时电子守恒的应用,题目难度中等.

 导学全程练创优训练系列答案
导学全程练创优训练系列答案| A. | 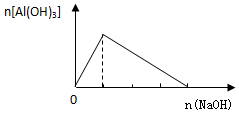 向AlCl3溶液中逐滴加入NaOH溶液 | |
| B. | 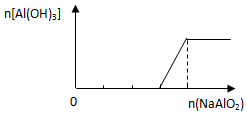 向稀盐酸中逐滴加入NaAlO2溶液 | |
| C. | 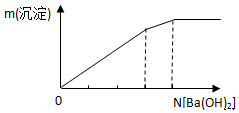 向明矾溶液中逐滴加入Ba(OH)2溶液 | |
| D. | 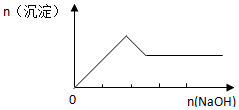 向Al2O3和Fe2O3的混合物中加入过量稀盐酸,向所得溶液中滴加NaOH的过程 |
| A. | X有多种同素异形体,而Y不存在同素异形体 | |
| B. | X、M均能与氯形成由极性键构成的XCl4、MCl4分子 | |
| C. | W的氧化物对应的水化物可与Z的最高价氧化物对应的水化物反应 | |
| D. | 离子半径大小:r(Y2-)>r(W3+) |
 碳、氮和铝的单质及其化合物在工农业生产和生活中有重要用途.
碳、氮和铝的单质及其化合物在工农业生产和生活中有重要用途.(1)真空碳热还原-氧化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
Al2O3(s)+AlCl3(g)+3C(s)═3AlCl(g)+3CO(g)△H=akJ•mol-1
3AlCl(g)═2Al(l)+AlCl3(g)△H=bkJ•mol-1
反应Al2O3(s)+3C(s)═2Al(l)+3CO(g)的△H=a+bkJ•mol-1(用含a、b的代数式表示);
(2)用活性炭还原法可以处理氮氧化物.某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g)?N2(g)+CO2(g)△H=Q kJ•mol-1.在T1℃时,反应进行到不同时间测得各物质的浓度如下:
 | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
| N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
| CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是ae(填字母编号).
a.通入一定量的NO b.通入一定量的N2 c.适当升高反应体系的温度
d.加入合适的催化剂 e.适当缩小容器的体积
③在恒容条件下,能判断该反应一定达到化学平衡状态的依据是cd (填选项编号).
a.单位时间内生成2nmolNO(g)的同时消耗nmolCO2(g)
b.反应体系的压强不再发生改变
c.混合气体的密度保持不变
d.混合气体的平均相对分子质量保持不变
④若保持与上述反应前3Omin的反应条件不变,起始时NO的浓度为2.50mol/L,则反应达平衡时c(NO)=1.25mol/L.NO的转化率不变(填“增大”、“减小”或“不变”).
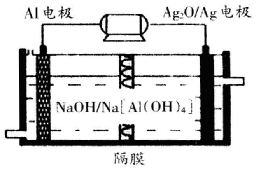
(3)铝电池性能优越,Al-Ag2O电池可用作水下动力电源,其原理如图所示
请写出该电池正极反应式Ag2O+2e-+H2O=2Ag+2OH-;常温下,用该化学电源和惰性电极电解300mL硫酸铜溶液(过量),消耗27mgAl,则电解后溶液的pH=2(不考虑溶液体积的变化).
| A. | 液氨汽化时要吸收大量的热,常用作制冷剂 | |
| B. | 压减燃煤、严格控车、调整产业是治理雾霾的有效措施 | |
| C. | 手机外壳上贴的碳纤维外膜是一种新型的无机非金属材料 | |
| D. | 纯碱可用于生产普通玻璃,也可用来治疗胃酸过多的病症 |
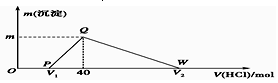
| A. | 原合金质量为0.92 g | |
| B. | 图中V2为60 | |
| C. | 整个滴定过程中Na+的浓度保持不变 | |
| D. | OP段发生的反应为:NaOH+HCl═NaCl+H2O |
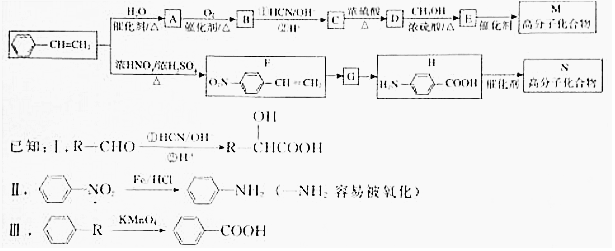
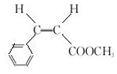 .
. 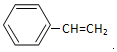 →F的反应类型为取代 反应.
→F的反应类型为取代 反应.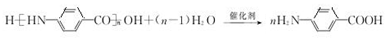 .
.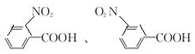 .
.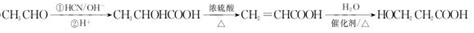 .
.