题目内容
3NO2+H2O═2HNO3+NO,被氧化的NO2与被还原的NO2的物质的量之比是 .
考点:氧化还原反应
专题:
分析:该反应中N元素化合价由+4价变为+5价、+2价,所以NO2既是氧化剂又是还原剂,被氧化的NO2的二氧化氮生成HNO3,被还原的NO2生成NO,根据N元素守恒结合方程式中化学计量数进行判断.
解答:
解:该反应中N元素化合价由+4价变为+5价、+2价,所以NO2既是氧化剂又是还原剂,反应3NO2+H2O═2HNO3+NO中被氧化的NO2的二氧化氮生成HNO3,被还原的NO2生成NO,根据N元素守恒可知被氧化的NO2与被还原的NO2的物质的量之比为2:1,故答案为:2:1.
点评:本题考查氧化还原反应,比较基础,注意根据化合价理解氧化还原反应有关基本概念.

练习册系列答案
相关题目
下列离子方程式正确的是( )
| A、等物质的量浓度的FeI2溶液与溴水等体积混合2Fe2++2I-+2Br2=2Fe3++I2+4Br- |
| B、氢氧化铁溶于氢碘酸中:Fe(OH)3+3H+═Fe3++3H2O |
| C、次氯酸钙溶液中通入过量二氧化碳 Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO |
| D、向硫酸氢钠溶液中滴加Ba(OH)2溶液恰好至中性2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O |
下列指定反应的离子方程式正确的是( )
| A、Cu溶于稀硝酸:Cu+2H++NO3-=Cu2++NO2↑+H2O |
| B、向NaAlO2溶液中通入过量CO2制Al(OH)3:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3- |
| C、(NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-=Fe(OH)2↓ |
| D、用CuCl2溶液做导电性实验,灯泡发光:CuCl2=Cu2++2Cl- |
乙烯是重要的有机化工原料.下列关于乙烯的有关说法中不正确的是( )
| A、一种植物生长调节剂 |
| B、易燃 |
| C、能使溴水、酸性高锰酸钾溶液褪色 |
| D、与甲烷互为同系物 |
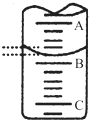 某研究性小组用0.20mol/L NaOH溶液滴定未知浓度的白醋(指示剂为酚酞).
某研究性小组用0.20mol/L NaOH溶液滴定未知浓度的白醋(指示剂为酚酞). 一密闭容器中发生下列反应:N2(g)+3H2(g)?2NH3(g);△H<0
一密闭容器中发生下列反应:N2(g)+3H2(g)?2NH3(g);△H<0