题目内容
某学习小组在研究CH4还原Fe2O3的实验中,发现生成的黑色粉末各组分均能被磁铁吸引.查阅资料得知:在温度不同、受热不均时会生成具有磁性的Fe3O4(组成相当于Fe2O3?FeO).为进一步探究黑色粉末的组成及含量,他们进行了如下实验.
(1)往黑色粉末中滴加盐酸,发现有气泡产生,则黑色粉末中一定有 ,产生气泡的离子方程式为 .
(2)热还原法检验:按如图所示装置连接好仪器(图中夹持设备已略去),检查装置的气密性.往装置中添加药品.打开止水夹K通人氢气,持续一段时间后再点燃C处的酒精灯.
请回答下列问题:
①点燃C处酒精灯之前,为何要先持续通H2一段时间 .
②B中试剂的名称是_ .
③若加热一段时间后,装置D中白色粉末变蓝色,对黑色粉末的组成得出的结论是 .
(3)为证明黑色粉末是否含Fe3O4,某同学还进行了如下实验:取少量黑色粉末于试管,加足量盐酸,充分振荡使黑色粉末完全溶解,所得溶液分两份,第一份溶液滴入KSCN溶液,观察溶液是否变红;第二份溶液滴入酸性KMnO4溶液,观察酸性KMnO4溶液是否褪色.请回答:第一份溶液滴入KSCN溶液后一定会变红吗? (填“是”或“否”);第二份溶液所进行的操作是欲检验溶液中是否存在 离子.经分析,你认为此方案是否可行 (填“是”或“否”).
(1)往黑色粉末中滴加盐酸,发现有气泡产生,则黑色粉末中一定有
(2)热还原法检验:按如图所示装置连接好仪器(图中夹持设备已略去),检查装置的气密性.往装置中添加药品.打开止水夹K通人氢气,持续一段时间后再点燃C处的酒精灯.

请回答下列问题:
①点燃C处酒精灯之前,为何要先持续通H2一段时间
②B中试剂的名称是_
③若加热一段时间后,装置D中白色粉末变蓝色,对黑色粉末的组成得出的结论是
(3)为证明黑色粉末是否含Fe3O4,某同学还进行了如下实验:取少量黑色粉末于试管,加足量盐酸,充分振荡使黑色粉末完全溶解,所得溶液分两份,第一份溶液滴入KSCN溶液,观察溶液是否变红;第二份溶液滴入酸性KMnO4溶液,观察酸性KMnO4溶液是否褪色.请回答:第一份溶液滴入KSCN溶液后一定会变红吗?
考点:探究物质的组成或测量物质的含量
专题:
分析:(1)还原Fe2O3的实验中,发现生成的黑色粉末各组分均能被磁铁吸引,往黑色粉末中滴加盐酸,观察到有气泡产生,证明含有金属铁;
(2)此流程为:A装置产生氢气,B装置干燥氢气,C装置还原黑色粉末,D装置检验生成产物水,E装置吸收空气中水和二氧化碳,
①氢气是可燃性气体,混有氧气会发生爆炸危险;
②气体进入C装置前需要除去水蒸气,否则以炸裂玻璃管;
③D中白色粉末硫酸铜变蓝色证明反应有水生成,黑色固体中含有的Fe3O4被氢气还原生成水;
(3)黑色粉末加入足量盐酸溶解后,滴入KSCN溶液,可能变红,也可能不变红色,不变红可能有两种情况,一种是无铁离子存在,一种是有铁离子存在,和过量的铁反应生成亚铁离子;高锰酸钾具有强氧化性,能把亚铁离子氧化成铁离子,同时高锰酸钾也会把氯离子氧化,使高锰酸钾褪色.
(2)此流程为:A装置产生氢气,B装置干燥氢气,C装置还原黑色粉末,D装置检验生成产物水,E装置吸收空气中水和二氧化碳,
①氢气是可燃性气体,混有氧气会发生爆炸危险;
②气体进入C装置前需要除去水蒸气,否则以炸裂玻璃管;
③D中白色粉末硫酸铜变蓝色证明反应有水生成,黑色固体中含有的Fe3O4被氢气还原生成水;
(3)黑色粉末加入足量盐酸溶解后,滴入KSCN溶液,可能变红,也可能不变红色,不变红可能有两种情况,一种是无铁离子存在,一种是有铁离子存在,和过量的铁反应生成亚铁离子;高锰酸钾具有强氧化性,能把亚铁离子氧化成铁离子,同时高锰酸钾也会把氯离子氧化,使高锰酸钾褪色.
解答:
解:(1)还原Fe2O3的实验中,发现生成的黑色粉末各组分均能被磁铁吸引,应为铁或四氧化三铁,或者二者混合物,往黑色粉末中滴加盐酸,观察到有气泡产生,证明含有金属铁;发生反应Fe+2HCl=FeCl2+H2↑黑色粉末中一定含有铁,
故答案为:Fe;Fe+2H+=Fe2++H2↑;
(2)①氢气是可燃性气体,混有氧气会发生爆炸危险,故应先通一会氢气,验纯后再加热C装置,
故答案为:排尽装置内的空气,防止H2与空气混和,受热时发生爆炸;
②气体进入C装置前需要除去水蒸气,否则会需要产物水蒸气的检验,有可能炸裂玻璃管,吸收氢气中的水蒸气用浓硫酸溶液,
故答案为:浓硫酸;
③D中白色粉末硫酸铜变蓝色证明反应有水生成,黑色固体中含有Fe3O4 被氢气还原生成水,发生反应4H2+Fe3O4
3Fe+4H2O,所以黑色固体中含有四氧化三铁,
故答案为:黑色固体含有Fe3O4;
(3)黑色粉末加入足量盐酸溶解后,滴入KSCN溶液,不一定变红,因为固体中含有Fe,生成的Fe3+可能全被Fe还原:2Fe3++Fe═3Fe2+,加入KSCN溶液不变红;高锰酸钾具有强氧化性,能把亚铁离子氧化成铁离子,同时高锰酸钾也会把氯离子氧化,使高锰酸钾褪色,因此不能根据高锰酸钾褪色就证明含亚铁离子,氯离子干扰亚铁离子的检验,
故答案为:否; Fe2+;否.
故答案为:Fe;Fe+2H+=Fe2++H2↑;
(2)①氢气是可燃性气体,混有氧气会发生爆炸危险,故应先通一会氢气,验纯后再加热C装置,
故答案为:排尽装置内的空气,防止H2与空气混和,受热时发生爆炸;
②气体进入C装置前需要除去水蒸气,否则会需要产物水蒸气的检验,有可能炸裂玻璃管,吸收氢气中的水蒸气用浓硫酸溶液,
故答案为:浓硫酸;
③D中白色粉末硫酸铜变蓝色证明反应有水生成,黑色固体中含有Fe3O4 被氢气还原生成水,发生反应4H2+Fe3O4
| ||
故答案为:黑色固体含有Fe3O4;
(3)黑色粉末加入足量盐酸溶解后,滴入KSCN溶液,不一定变红,因为固体中含有Fe,生成的Fe3+可能全被Fe还原:2Fe3++Fe═3Fe2+,加入KSCN溶液不变红;高锰酸钾具有强氧化性,能把亚铁离子氧化成铁离子,同时高锰酸钾也会把氯离子氧化,使高锰酸钾褪色,因此不能根据高锰酸钾褪色就证明含亚铁离子,氯离子干扰亚铁离子的检验,
故答案为:否; Fe2+;否.
点评:本题考查了探究物质组成、测定物质含量的定量实验操作和实验设计,题目难度中等,侧重考查铁及其化合物的性质应用、实验基本操作的分析判断、实验现象的推断和应用,试题综合性较强,有利于培养学生灵活应用基础知识的能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 如图中,锥形瓶内盛有气体X,滴管内盛有液体Y,若挤压滴管胶头,使液体Y滴入瓶中,振荡,一会儿可见小气球a鼓起.气体X和液体Y不可能是( )
如图中,锥形瓶内盛有气体X,滴管内盛有液体Y,若挤压滴管胶头,使液体Y滴入瓶中,振荡,一会儿可见小气球a鼓起.气体X和液体Y不可能是( )| A、X是HCl,Y是饱和食盐水 |
| B、X是CO2,Y是稀H2SO4 |
| C、X是SO2,Y是NaOH溶液 |
| D、X是NH3,Y是NaNO3溶液 |
下列叙述中肯定A金属比B金属的活泼性强的是( )
| A、A原子的最外层电子数比B原子的最外层电子数少 |
| B、A的氢氧化物为两性化合物,B的氢氧化物为碱 |
| C、A元素的电负性比B元素的电负性小 |
| D、1摩尔A从酸中置换出H+生成的氢气比1摩尔B从酸中置换的H+生成的氢气多 |
工业上用洗净的废铜屑作原料来制备硝酸铜.为了节约原料和防止污染环境,宜采用的方法是( )
| A、Cu+HNO3(浓)→Cu(NO3)2 |
| B、Cu+HNO3(稀)→Cu(NO3)2 |
| C、Cu+空气→CuO CuO+HNO3→Cu(NO3)2 |
| D、Cu+浓硫酸→CuSO4 CuSO4+Ba(NO3)2→Cu(NO3)2 |
 如图所示装置进行试验((图中铁架台仪器均已略去),在Ⅰ中加入试剂后,塞紧 橡皮塞,立即打开止水夹,Ⅱ中有气泡冒出,一段时间后关闭止水夹,Ⅱ中液面上升,溶液由无色变为浑浊.符合以上试验现象的Ⅰ和Ⅱ中应加入的试剂是( )
如图所示装置进行试验((图中铁架台仪器均已略去),在Ⅰ中加入试剂后,塞紧 橡皮塞,立即打开止水夹,Ⅱ中有气泡冒出,一段时间后关闭止水夹,Ⅱ中液面上升,溶液由无色变为浑浊.符合以上试验现象的Ⅰ和Ⅱ中应加入的试剂是( )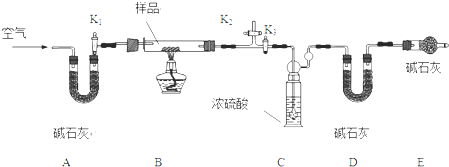
 验室用如图所示的装置制取乙酸乙酯.
验室用如图所示的装置制取乙酸乙酯.