题目内容
已知5KCl+KClO3+3H2SO4═3Cl2↑+3K2SO4+3H2O,下列说法不正确的是( )
| A、KClO3是氧化剂 |
| B、被氧化与被还原的氯元素的质量比为1:5 |
| C、H2SO4既不是氧化剂又不是还原剂 |
| D、1molKClO3参加反应时有5mol电子转移 |
考点:氧化还原反应
专题:氧化还原反应专题
分析:5KCl+KClO3+3H2SO4═3Cl2↑+3K2SO4+3H2O中,Cl元素的化合价由-1价升高为0,Cl元素的化合价由+5价降低为0,该反应转移5e-,以此来解答.
解答:
解:A.KClO3中Cl元素的化合价降低,则是氧化剂,故A正确;
B.5个Cl失去电子与1个Cl得电子数目相等,则被氧化与被还原的氯元素的质量比为5:1,故B错误;
C.H、S、O元素的化合价不变,H2SO4既不是氧化剂又不是还原剂,故C正确;
D.1molKClO3参加反应时有1mol×(5-0)=5mol电子转移,故D正确;
故选B.
B.5个Cl失去电子与1个Cl得电子数目相等,则被氧化与被还原的氯元素的质量比为5:1,故B错误;
C.H、S、O元素的化合价不变,H2SO4既不是氧化剂又不是还原剂,故C正确;
D.1molKClO3参加反应时有1mol×(5-0)=5mol电子转移,故D正确;
故选B.
点评:本题考查氧化还原反应,为高考高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念和转移电子的考查,题目难度不大.

练习册系列答案
相关题目
有两个无标签的试剂瓶,分别装有Na2CO3和NaHCO3固体,有四位同学为鉴别它们采用以下不同方法,其中不可行的是( )
| A、分别将它们配制成溶液,再加入澄清石灰水 |
| B、分别将它们配制成溶液,再逐滴加入等浓度的稀盐酸 |
| C、分别将它们配制成溶液,再加入CaCl2溶液 |
| D、分别加热,再用石灰水检测是否有CO2产生 |
下列反应属于吸热反应的是( )
| A、生石灰和水的反应 |
| B、煅烧石灰石 |
| C、盐酸与氢氧化钠溶液的反应 |
| D、木炭在氧气中燃烧 |
 如图中每条折线表示元素周期表中第ⅣA~ⅦA族中的某一族元素氢化物的沸点变化.每个小黑点代表一种氢化物,其中a点代表的是( )
如图中每条折线表示元素周期表中第ⅣA~ⅦA族中的某一族元素氢化物的沸点变化.每个小黑点代表一种氢化物,其中a点代表的是( )| A、H2Se |
| B、GeH4 |
| C、AsH3 |
| D、HBr |
离子方程式H++OH-═H2O所表示的反应是( )
| A、所有酸和碱之间的中和反应 |
| B、所有强酸和强碱之间的中和反应 |
| C、强酸溶液与强碱溶液生成可溶性盐和水的反应 |
| D、所有可溶性酸和可溶性碱之间的中和反应 |
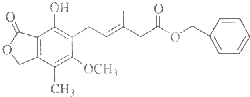 有关如图所示化合物的说法正确的是( )
有关如图所示化合物的说法正确的是( )| A、既可以与Br2的CCl4溶液发生加成反应,不能在光照下与Br2发生取代反应 |
| B、既可以催化加氢,又可以使酸性KMnO4溶液褪色 |
| C、既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2气体 |
| D、1mol该化合物最多可以与4mol NaOH反应 |
设一个12C原子质量为a g,一个R原子质量为b g,阿伏加德罗常数的数值为NA,则R原子的摩尔质量为( )
A、
| ||
| B、b×NA g/mol | ||
| C、12 b×a g/mol | ||
| D、a×NAg/mol |
 在一定温度下,容器内某一反应中两种气态物质M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )
在一定温度下,容器内某一反应中两种气态物质M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )| A、反应的化学方程式为:2M?N | ||
| B、t2时,正逆反应速率相等,反应达到平衡状态 | ||
| C、t3时,M上a点正反应速率等于N上b点的逆反应速率 | ||
D、
|
