题目内容
常温下,将20mL 0.1mol/L的HCl溶液逐滴加入到20mL 0.1mol/L Na2C2O4溶液中.已知NaHC2O4溶液显酸性,关于反应混合溶液的下列判断不正确的是( )
| A、加水稀释时,溶液中c(OH-)增大,其余离子浓度均减小 | ||
B、
| ||
| C、c(Na+)>c(Cl-)>c(HC2O4-)>c(C2O42-)>c(H2C2O4) | ||
| D、c(Cl-)=c(HC2O4-)+2c(C2O42-)+c(HC2O4) |
考点:离子浓度大小的比较
专题:盐类的水解专题
分析:20mL 0.1mol/L的HCl溶液逐滴加入到20mL 0.1mol/L Na2C2O4溶液中,二者恰好反应生成等物质的量浓度 NaCl和 NaHC2O4,溶液呈酸性,说明HC2O4-的电离程度大于水解程度,溶液中存在电荷守恒和物料守恒,据此解答.
解答:
解:20mL 0.1mol/L的HCl溶液逐滴加入到20mL 0.1mol/L Na2C2O4溶液中,二者恰好反应生成等物质的量浓度 NaCl和 NaHC2O4,溶液呈酸性,说明HC2O4-的电离程度大于水解程度,
A.加水稀释促进盐类水解,但溶液酸性减弱,温度不变,水的离子积常数不变,则c(OH-)增大,其余离子浓度都减小,故A正确;
B.溶液中存在电荷守恒c(Na+)+c(H+)=c(HC2O4-)+2c(C2O42-)+c(OH-)+c(Cl-),根据物料守恒得c(Na+)=2c(Cl-),所以存在
c(Na+)+c(H+)=c(HC2O4-)+2c(C2O42-)+c(OH-),故B正确;
C.c(Na+)=2c(Cl-),酸式盐NaHC2O4的溶液呈酸性,说明HC2O4-电离程度大于HC2O4-水解程度,所以c(HC2O4-)>c(C2O42-)>c(HC2O4),即c(Na+)>c(Cl-)>c(Cl-)>c(HC2O4-)>c(C2O42-)>c(HC2O4),故C正确;
D.根据物料守恒可知:n(HCl)=n(Na2C2O4),即:c(Cl-)=c(HC2O4-)+c(C2O42-)+c(H2C2O4)故D错误;
故选D.
A.加水稀释促进盐类水解,但溶液酸性减弱,温度不变,水的离子积常数不变,则c(OH-)增大,其余离子浓度都减小,故A正确;
B.溶液中存在电荷守恒c(Na+)+c(H+)=c(HC2O4-)+2c(C2O42-)+c(OH-)+c(Cl-),根据物料守恒得c(Na+)=2c(Cl-),所以存在
| 1 |
| 2 |
C.c(Na+)=2c(Cl-),酸式盐NaHC2O4的溶液呈酸性,说明HC2O4-电离程度大于HC2O4-水解程度,所以c(HC2O4-)>c(C2O42-)>c(HC2O4),即c(Na+)>c(Cl-)>c(Cl-)>c(HC2O4-)>c(C2O42-)>c(HC2O4),故C正确;
D.根据物料守恒可知:n(HCl)=n(Na2C2O4),即:c(Cl-)=c(HC2O4-)+c(C2O42-)+c(H2C2O4)故D错误;
故选D.
点评:本题考查了离子浓度大小比较,明确溶质的性质及溶液酸碱性再结合电荷守恒、物料守恒来分析解答,离子浓度大小比较常常与弱电解质的电离、盐类水解综合考查,为高考高频点,要熟练掌握,题目难度中等.

练习册系列答案
相关题目
下列说法正确的是( )


| A、装置甲不能防止铁钉生锈 |
| B、装置乙可除去乙烯中混有的乙炔 |
| C、装置丙可用于实验室制取乙酸乙酯 |
| D、装置丁可用于收集H2、CO2、Cl2、HCl、NO2等气体 |
短周期元素X、Y、Z、W的原子序数依次增大,X的原子在元素周期表中原子半径最小,Y的次外层电子数是最外层的
,ZX2是一种储氢材料,W与Y属于同一主族.下列叙述正确的是( )
| 1 |
| 3 |
| A、原子半径:rW>rZ>rY |
| B、Y形成的离子与W形成的离子的电子数不可能相同 |
| C、化合物X2Y、ZY、WY3中化学键的类型相同 |
| D、由X、Y、Z、W组成的化合物的水溶液可能显酸性 |
如部分短周期元素原子半径与原子序数的关系图.则下列说法正确的是( )


| A、Y、R两种元素的气态氢化物及其最高价氧化物的水化物均为强酸 |
| B、简单离子的半径:X>Z>M |
| C、由X与N两种元素组成的化合物不能与任何酸反应,但能与强碱反应 |
| D、Z单质能从M与R元素构成的盐溶液中置换出单质M |
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A、水电离出的c(H+)?c(OH-)=10-22的溶液:K+、Na+、SO42-、S2O32- |
| B、澄清透明溶液:Mg2+、Cu2+、Cl-、SO42- |
| C、使酚酞变红色的溶液:NH4+、K+、AlO2-、NO3- |
| D、含0.1mol?L-1 KI的溶液:Fe3+、Na+、NO3-、Cl- |
现有常温下的五种溶液(如表).下列有关叙述中正确的是( )
| (1) | (2) | (3) | (4) | (5) | |
| 溶液 | 氨水 | 氢氧化钠 | 醋酸 | 盐酸 | 醋酸铵 |
| pH | 11 | 11 | 3 | 3 | 8.3 |
| A、五种溶液中,水电离出的c(OH-)最小的是⑤ |
| B、将①、④两种溶液等体积混合,所得溶液中:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| C、分别将①、②、③、④加水稀释100倍,稀释后四种溶液的pH:①>②>③>④ |
| D、在⑤中加入适量的④至溶液呈中性,所得溶液中:c(Na+)>c(CH3COO-)>c(Cl-)>c(H+)=c(OH-) |
下列实验,能达到实验目的是( )
A、 配置一定物质的量浓度的H2SO4溶液 |
B、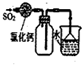 收集和吸收多余的SO2 |
C、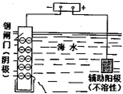 保护钢闸门不被腐蚀 |
D、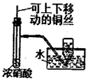 制取和收集NO2 |
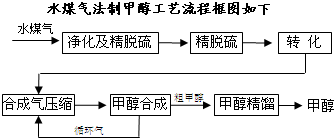 将煤气化转化成合成气,然后通过一碳化工路线合成各种油品和石化产品是一碳化工的极为重要的领域,具有广阔的前景,在未来相当一段时期将成为一碳化工的主要领域.
将煤气化转化成合成气,然后通过一碳化工路线合成各种油品和石化产品是一碳化工的极为重要的领域,具有广阔的前景,在未来相当一段时期将成为一碳化工的主要领域.