题目内容
1.下列关于Na2CO3和NaHCO3的说法中正确的是( )| A. | 同温度、同浓度两种溶液的pH:Na2CO3>NaHCO3 | |
| B. | 可以用澄清石灰水鉴别Na2CO3和NaHCO3溶液 | |
| C. | 由于NaHCO3溶液呈碱性,所以HCO3-在溶液中未电离 | |
| D. | 两种溶液中都存在:c(H+)+c(Na+)=c(CO32-)+c(HCO3-)+c(OH-) |
分析 A.碳酸根离子的水解程度大于碳酸氢根离子,则碳酸钠溶液的pH较大;
B.氢氧化钙能够与碳酸钠、碳酸氢钠反应生成碳酸钙沉淀;
C.碳酸氢根离子既能够电离,还能够水解,由于电离程度小于水解程度,则碳酸氢钠溶液呈碱性;
D.根据两溶液中的电荷守恒判断.
解答 解:A.同温度、同浓度两种溶液中,碳酸钠的水解程度大于碳酸氢钠,则溶液的pH:Na2CO3>NaHCO3,故A正确;
B.碳酸钠和碳酸氢钠都能够与氢氧化钙反应生成碳酸钙沉淀,则不能用澄清石灰水鉴别Na2CO3和NaHCO3溶液,故B错误;
C.NaHCO3溶液呈碱性,是由于HCO3-的水解程度大于其电离程度,故C错误;
D.两种溶液中都存在电荷守恒:c(H+)+c(Na+)=2c(CO32-)+c(HCO3-)+c(OH-),故D错误;
故选A.
点评 本题考查了离子浓度大小比较、钠的化合物性质,题目难度不大,明确常见元素及其化合物性质为解答关键,注意掌握电荷守恒的含义及盐的水解,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
11.下列与实验相关的叙述正确的是( )
| A. | 稀释浓硫酸时,应将蒸馏水沿玻璃棒缓慢注入浓硫酸中 | |
| B. | 配制溶液时,若加水超过容量瓶刻度,应用胶头滴管将多余溶液吸出 | |
| C. | 从碘水中提取单质碘时,不能用无水乙醇代替CCl4 | |
| D. | 取少量溶液依次加入BaCI2溶液和稀盐酸产生白色沉淀,则原溶液一定含有SO42- |
12.已知HF、CH3COOH均为弱酸,酸性强弱顺序为HF>CH3COOH,下列说法正确的是( )
| A. | 浓度均为0.1 mol•L-1的NaF、CH3COONa溶液相比较,CH3COONa溶液碱性较强 | |
| B. | 0.1 mol•L-1 CH3COOH溶液,加水稀释过程中,所有离子浓度均减小 | |
| C. | NaF溶液中只含有Na+、F-、H+、OH-、H2O五种微粒 | |
| D. | NaF溶液中加入少量NaOH固体,溶液中c(F-)变小 |
9.下列叙述正确的是( )
| A. | 元素的单质不能通过氧化含该元素的化合物制得 | |
| B. | 得电子越多的氧化剂,其氧化性就越强 | |
| C. | 阳离子只能得到电子被还原,只能作氧化剂 | |
| D. | 含有最高价元素的化合物不一定具有强的氧化性 |
6.磷元素的原子结构示意图为 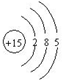 ,则磷元素位于周期表中( )
,则磷元素位于周期表中( )
 ,则磷元素位于周期表中( )
,则磷元素位于周期表中( )| A. | 第3周期,第ⅢA族 | B. | 第5周期,第ⅤA族 | C. | 第5周期,第ⅢA族 | D. | 第3周期,第ⅤA族 |
13.有机物与人类的生产和生活密切相关,下列有关有机物及其反应的认识正确的是( )
| A. | 有机物不具备无机物的性质 | |
| B. | 有机物参与的反应,一般比较复杂,反应速率较慢,且常伴有副反应发生 | |
| C. | 有机物和无机物之间是不可能相互转化的两类物质 | |
| D. | 所有有机化合物均易燃烧 |